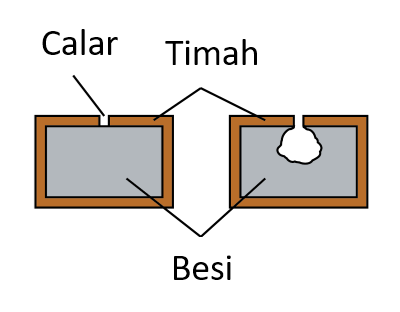
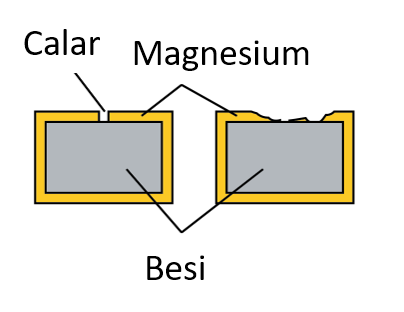
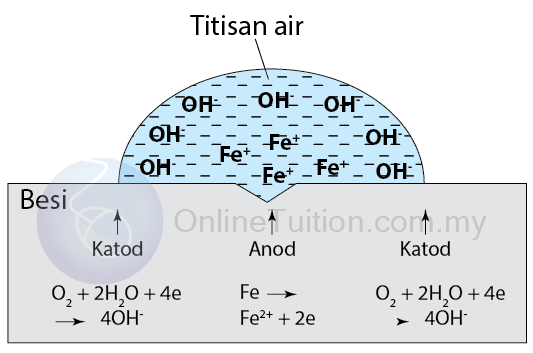
Sudut tuju, i sama dengan sudut pantulan, r.
Soal dan Jawab
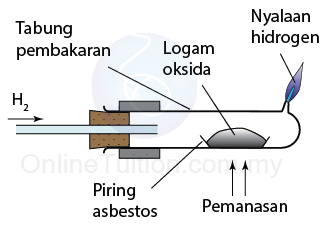
Mengapa papan lapis keras digunakan?
Permukaan yang keras adalah pemantul bunyi yang baik. Papan lapis keras digunakan supaya tenaga yang hilang semasa pantulan adalah minimum..
Soal dan Jawab
Mengapa jam randik mekanikal digunakan sebagai sumber suara?
Kerana bunyinya tidak terlalu kuat sehingga ia boleh didengar terus (tanpa pantulan) oleh pemerhati.
Soal dan Jawab
Mengapa tiub kadbod digunakan?
Tiub kadbod digunakan untuk membantu menentukan arah gelombang bunyi tuju dan gelombang bunyi yang dipantulkan..
Soal dan Jawab
Mengapa kayu lembut diletak di antara jam randik dan pemerhati?
Kayu lembut dapat menyerap sebarang bunyi dari jam randik dan menghalangnya daripada mencapai pemerhati..