Sebatian Karbon
Ester
- Ester ialah sebatian organik bukan hidrokarbon yang mengandungi karbon, hidrogen dan oksigen.
- Ia terbentuk apabila asid karboksilik bertindak balas dengan alkohol.
Formula Am:
Di mana
m = 0, 1, 2, 3
n = 1, 2, 3
Contoh
| Ester | Formula |
| Metil metanoat (m=0, n=1) | HCOOCH3 |
| Etil metanoat (m=1, n=1) | CH3COOCH3 |
| Etil etanoat (m=1, n=2) | CH3COOC2H5 |
| Propil etanoat (m=2, n=2) | C2H5COO C2H5 |
Kumpulan berfungsi:
Pembentukan:
- Ester dihasilkan apabila asid karboksilik bertindak balas dengan alkohol dengan kehadiran asid sulfurik pekat sebagai mangkin.
- Tindak balas ini dipanggil tindak balas pengesteran.
Sifat Fizik Ester
- Ester mempunyai ciri-ciri berikut:
- Mempunyai wangi yang serupa dengan buah-buahan
- Tidak larut dalam air tetapi larut dalam pelarut organik
- Takat mendidih yang rendah
- Kurang tumpat daripada air
- Cecair tidak berwarna
- Tidak meruap
- Dalam alam semulajadi, ester boleh ditemui di dalam tumbuhan.
Kegunaan Ester dalam Kehidupan Harian
- Sebagai perisa makanan
- Sebagai pewangi dalam sabun dan detergen
- Untuk membuat barangan kosmetik (minyak wangi)
- Untuk membuat ubat
Sifat-sifat Kimia Asid Karboksilik
- Asid etanoik ialah asid monoprotik yang lemah. Oleh itu, sifat kimianya adalah serupa dengan asid yang lain seperti asid hidroklorik, asid nitrik dan asid sulfurik.
- Asid etanoik boleh bertindak balas dengan:
- bes
- logam karbonat
- logam
- alkohol
Asid Karboksilik Bertindak dengan Logam Reaktif
Asid carboxylic bertindak dengan logam yang lebih reaktif untuk menghasilkan garam dan gas hidrogen.
Contoh:
2CH3COOH + Zn → Zn(CH3COO)2 + H2
2CH3COOH + Ca → Ca(CH3COO)2 + H2
2HCOOH + Mg → Mg(HCOO)2 + H2
Asid Karboksilik Bertindak Dengan Karbonat
Sama seperti asid lain, asid karboksilat bertindak balas dengan logam karbonat untuk menghasilkan garam, air dan karbon dioksida.
→ Garam+ Karbon dioksida + Air
Contoh:
HCOOH + Na2CO3 → HCOONa + CO2 + H2O
CH3COOH + CaCO3 → Ca(CH3COO)2 + CO2 + H2O
Peneutralan
Sama seperti asid lain, asid karboksilik bertindak balas dengan oksida bes atau alkali untuk menghasilkan garam dan air.
Contoh:
HCOOH + CaO → Ca(HCOO)2 + H2O
CH3COOH + NaOH → CH3COONa + H2O
CH3COOH + Al2O3 → Al(CH3COO)3 + H2O
Pengesteran
Asid karboksilat bertindak balas dengan alkohol dengan kehadiran asid sulfurik pekat sebagai mangkin menghasilkan ester dan air.
Contoh:
CH3COOH + C2H5OH → CH3COOC2H5 + H2O
CH3COOH + CH3OH → CH3COOCH3 + H2O
- Asid sulfurik pekat bertindak sebagai
- agen pengeringan untuk menyerap air yang dihasilkan
- memangkin
- Campuran bahan tindak balas perlu dipanaskan di bawah refluks.
Penyediaan Propil Etanoate (ester) di Dalam Makmal
- Propil etanoat, CH3COOC2H5 boleh disediakan di dalam makmal dengan memanaskan campuran asid propanoik dan etanol, dengan asid sulfurik pekat di bawah refluks.
- Campuran dipanaskan di bawah refluks untuk mengelakkan alkohol dan propil etanoat daripada mengewap dan terlepas ke sekeliling.
- Campuran dipanaskan di bawah kukus air:
- untuk mengekalkan suhu supaya suhu tidak terlalu tinggi
- untuk memastikan pemanasan seragamcan

Penyediaan Asid Karboksilik
Menghasilkan Asid Karboksilik Dengan Pengoksidaan Alkohol
- Alkohol boleh dioksidakan untuk membentuk asid karboksilik dengan menggunakan larutan kalium dikromat(VI) dan kehadiran asid sulfurik cair.
- Persamaan Kimia di bawah mewakili tindak balas ini.
C2H5OH+2[O] → CH3COOH + H2O - Rajah di bawah menunjukkan radas yang digunaka untuk menyediakan asid etanoik.
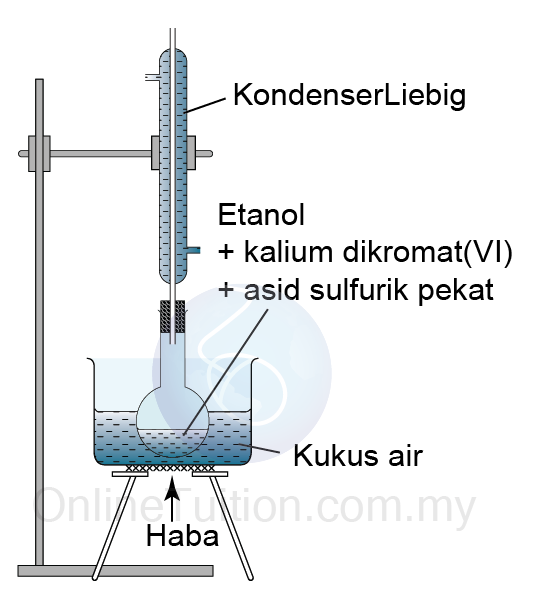
- Campuran dipanaskan di bawah refluks untuk mencegah etanol mengewap dan terlepas ke sekelilingnya sebelum ia mempunyai masa yan emncukupi untuk dioksidakan kepada asid karboksilik.
- Wap etanol akan dikondensasi menjadi cecair dalam kondenser Liebig, seterusnya mengalir kembali ke dalam balang untuk menyelesaikan tindak balas.
- Campuran ini dipanaskan dengan menggunakan kukus air:
- untuk memastikan suhu adalah tetap
- untuk memastikan pemanasan seragam (haba dibekalkan dengan sama rata)
Sifat-sifat Fizik Asid Karboksilik
Takat Didih
- Semakin banyak bilangan karbon di dalam molekul, semakin tinggi takat didih asid karboksilik.
- Takat didih asid karboksilik lebih tinggi daripada alkohol yang mempunyai bilangan karbon yang sama.
Kelarutan Dalam Air
- Asid karboksilik bermolekul kecil seperti asid metanoik dan asid etanoik boleh larut dalam air.
- Keterlarutan asid karboksilik menurum apabila saiz molekul meningkat. Ini adalah kerana rantai hidrokarbon yang lebih panjang menghalang di antara molekul air dan memecahkan ikatan hidrogen.
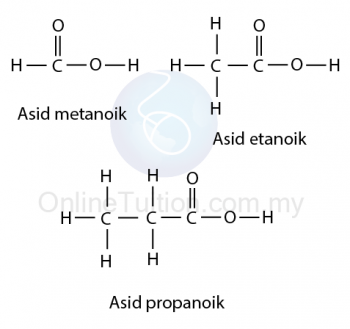
Asid Karboksilik
Penamaan Karboksilik
- Semua nama asid karboksilik berakhir dengan akhiran ‘oik’.
- Sebagai contoh, asid metanoik, asid etanoik, asid propanoik dan asid butanoik.
- Asid karboksilik dinamakan dengan menggantikan akhiran ‘ana’ pada nama alkana dengan ‘asid anoik’.
- Berlainan dengan alkohol, kedudukan kumpulan berfungsi (kumpulan karboksil) tidak perlu dinyatakan dalam nama asid karboksilik.
| Bilangan karbon | Nama alkana | Nama asid karboksilik |
|---|---|---|
| 1 | metana | asid metanoik |
| 2 | etana | asid etanoik |
| 3 | propana | asid propanoik |
| 4 | butana | asid butanoik |
| 5 | pentana | asid pentanoik |
| 6 | heksana | asid heksanoik |
Sifat-sifat Kimia Alkohol
Pembakaran Alkohol
- Sama seperti hidrokarbon, alkohol mengalami pembakaran dengan kehadiran oksigen untuk menghasilkan karbon dioksida dan air.
- Pembakaran alkohol menghasilkan api kurang jelaga berbanding dengan pembakaran alkana dan alkena disebabkan oleh kehadiran oksigen dalam kumpulan -OH.
- Disebabkan oleh kehadiran kumpulan -OH, peratus karbon dalam alkohol agak rendah berbanding dengan peratus karbon alkana dan alkena.
Persaman:
Pembakaran Etanol
Pembakaran Propanol
Tindak Balas Alkohol Dengan Air
Nota Ulangkaji:
Tindak balls di antara air dengan natrium (Unsur Kumpulan 1)
- Kami telah mempelajari tindak balas logam kumpulan 1 dengan air sejuk dalam Tingkatan 4, bab 4-Jadual Berkala.
- Tindak balas alkohol dengan natrium adalah serupa dengan tindak balas ini.
- Apabila seketul kecil natrium dimasukkan ke dalam etanol, ia bertindak balas dengan perlahan-lahan dan mengeluarkan gelembung gas hidrogen dan menghjasilkan larutan natrium etoksida, CH3CH2ONa.
- Natrium etoksida juga dikenali sebagai alkoksida.
- Dalam tindak balas ini, natrium bertindak dengan kumpulan alkosil -OH Membentuk natrium alkoksida dan gas hidrogen.
Contoh:
Metanol dan Natrium
Etanol dan natrium
Pendehidratan Alkohol
- Apabila alkohol dipanaskan, ia akan terurai membentuk alkena dan air.
- Sebagai contoh, pemanasan etanol akan menghasilkan etena, pemanasan propanol akan menghasilkan propena dan sebagainya.
- Proses ini dipanggil pendehidratan alkohol.
Pendehidratan Etanol
Pendehidratan Propanol
C3H7OH → C3H6 + H2O
Pendehidratan Alkohol Menggunakan Aluminium Oksida sebagai Mangkin
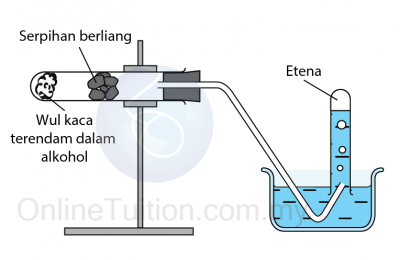
Mangkin: Aluminium oksida/ cip porselin
Pendehidratan Alkohol Menggunakan Asid Sebagai Mangkin
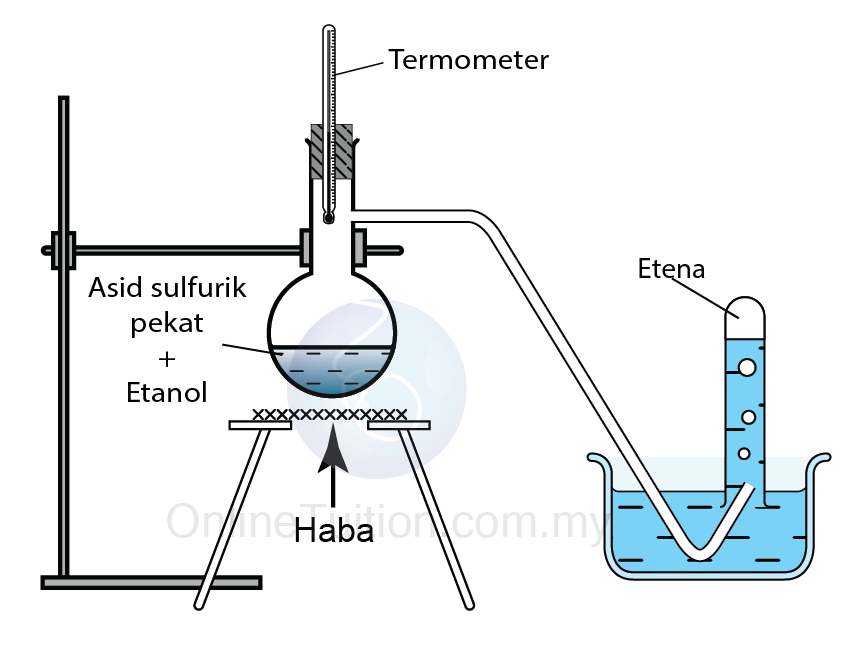
Mangkin: Asid sulfurik/asid fosforik
Suhu: 170°C
Pengoksidaan Alkkohol

Alkohol boleh dioksidakan untuk membentuk asid karboksilik apabila bertindak balas dengan agen pengoksidaan.
Persamaan:
Nota:
- Agen pengoksida yang digunakan:
- Kalium dikromat(VI) diasidkan
- Kalium manganat(VII) diasidkan
- Pemerhatian:
- Bagi pengoksidasi kalium dikromat (VI), jika pengoksidaan berlaku, larutan oren yang mengandungi ion dikromat(VI) diturunkan kepada larutan berwarna hijau yang mengandungi ion kromium(III).
- Bagi kalium permanganate(VII) berasid, warna ungu potassium permanganate (VII) dilunturkan.
- Alkohol dipanaskan di bawah refluks dengan agen pengoksidaan yang berlebihan.
- Teknik refluks yang digunakan untuk mengelakkan wap alkohol terlepas ke sekitarnya.
- Apabila tindak balas selesai, asid karboksilik akan disulingkan.
Penyedia Alkohol
- Penghidratan alkena
- Penapaian
Penghidratan Alkena
- Semasa kita membincang sifat-sifat kimia alkena, kita telah mengetahui bahawa, apabila alkena menjalani tindak balas peambahan dengan stim, alkohol akan dihasilkan. (lihat penghidratan alkena).
- Persamaan di bawah menunjukkan penghidratan etena dan propena untuk menghasilkan etanol dan propanol masing-masing.
Penghidratan Etena
Penghidratan Propena
Penapaian
- Kaedah ini hanya boleh digunakan untuk menyedia etanol.
- Penapaian adalah proses kimia di mana mikroorganisma seperti yis bertindak ke atas karbohidrat untuk menghasilkan etanol dan karbon dioksida.
- Apabila is ditambah kepada gula (contoh: glukosa), penapaian berlaku. Semasa penapaian, yis menghasilkan sejenis enzim yang bernama zimase. Enzim zimase boleh memecahkan molekul glukosa ke molekul yang lebih ringkas, iaitu etanol dan karbon dioksida.
\[{C_6}{H_{12}}{O_6}\xrightarrow{{yeast}}2{C_2}{H_5}OH + 2C{O_2}\] - Yis dibunuh oleh etanol apabila kepekatannya m melebihi 15%, dan menghadkan ketulenan etanol yang boleh dihasilkan.

Sifat-sifat Fizik Alkohol
Takat Didih
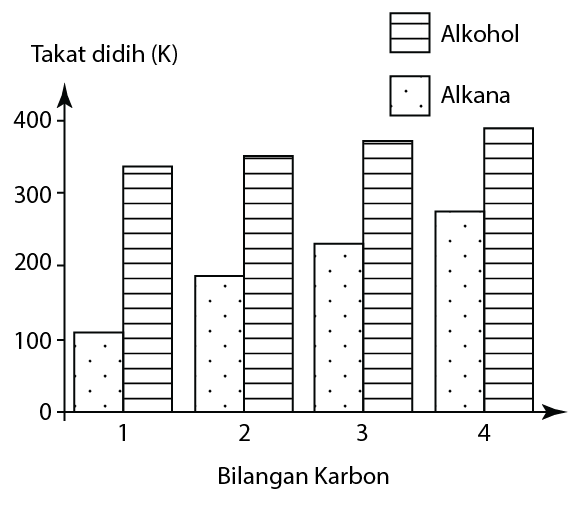
- Takat didih alkohol adalah lebih tinggi daripada alkana yang menpunyai bilangan atom karbon yang sama.
- Ini kerana, kehadiran kumpulan hidroksil dalam molekul memberikan daya tambahan di antara molekul, maka lebih banyak tenaga haba diperlukan untuk mengatasi daya intermolekul apabila mendidih.
- Takat didih alkohol meningkat apabila bilangan atom karbon bertambah. Ini dapat dijelaskan seperti berikut:
- Bilangan peningkatan karbon mengakibatkan saiz molekul meningkat.
- Peningkatan daya intermolecular.
- Lebih banyak tenaga haba diperlukan untuk mengatasi daya intermolekul ini.
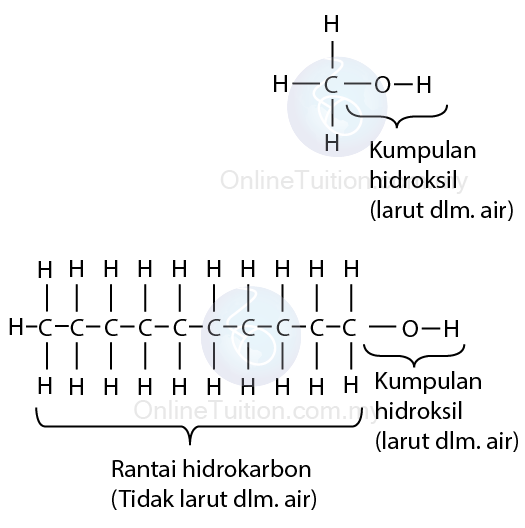
Ketelarutan Alkohol Di Dalam Air
- Alkohol bermokul kecil larut sepenuhnya di dalam air.
- Bagaimanapun, keterlarutan alkohol menurun apabila panajng rantaian hidrokarbon utamanya bertambah.
- Penjelasan:
Setiap alkohol terdiri daripada dua bahagian, rantaian hidrokarbon yang tidak larut dalam air, dan kumpulan berfungsi hidroksil, yang larut dalam air. - Bagi alkohol berantai pendek, kumpulan hidroksil memainkan peranan penting dalam membentuk daya (ikatan hidrogen) di antara air dan molekul alkohol, oleh itu ia larut dalam air.
- Bagi alkohol berantai panjang, kumpulan hidroksil hanya sebahagian kecil daripada molekul. Oleh itu, rantaian hidrokarbon panjang yang tidak larut menyumbang lebih kepada daya di antara molekul air dan alkohol, menyebabkan keterlarutan alkohol berkurang.