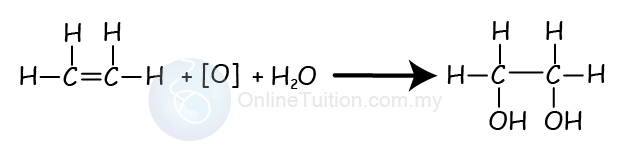admin
admin
Arus Elektrik Dalam Litar
Litar Bersiri
Arus mengalir memasuki satu perintang = arus mengalir di dalam perintang = arus mengalir keluar dari perintang.
Dalam litar bersiri, arus adalah sama di mana-mana titik di dalam litar.
Litar Selari
Arus mengalir keluar/memasuki satu litar selari sama dengan jumlah arus di setiap cabang litar selari itu.
Contoh
Sekiranya rintangan 2 perintang di dalam satu litar selari adalah sama, maka arus akan dibahagi sama rata di antara kedua-dua perintang itu.
Alkohol
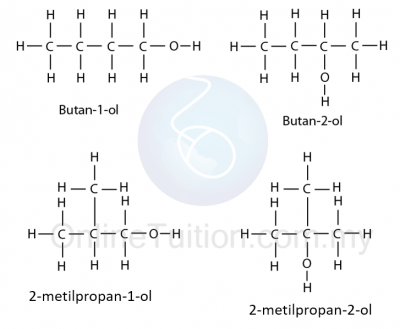
Penamaan Alkohol
- Semua ahli homolog alkohol mempunyai akhiran ‘anol’. Sebagai contoh, metanol, etanol, propanol ……
- Penamaan alkohol adalah sama seperti alkana, berdasarkan bilangan atom karbon dalam molekul, tetapi akhiran ‘ana’ dalam penamaan alkana digantikan dengan akhiran ‘anol’.
- Kedudukan kumpulan alkil dan hidroksil yang terikat pada rantai karbon ditunjukkan dengan penomboran atom karbon.
- Kumpulan hidroksil mesti selalu mendapat nombor terkecil yang mungkin.
Contoh 1
Rantai paling panjang: 3 carbon (propanol)
Kedudukan kumpulan hidroksil: 2
Alkil: –
Contoh 2
Rantai paling panjang: 5 carbon (pentanol)
Kedudukan kumpulan hidroksil: 1
Alkil: –
Contoh 3
Rantai paling panjang: 3 carbon (propanol)
Kedudukan kumpulan hidroksil: 2
Alkil: Metil di karbon ke-2
Contoh 4
Rantai paling panjang: 4 carbon (butanol)
Kedudukan kumpulan hidroksil: 1
Alkil: Metil di karbon-3
Contoh 5
Rantai paling panjang: 3 carbon (propanol)
Kedudukan kumpulan hidroksil: 1
Alkil: 2 Metil, kedua-dua di karbon ke-2
Kegunaan Alkohol
- Minuman
- Bahan api
- Pelarut
- Antiseptik



Perbandingan Sifat-sifat Alkana dan Alkena
Jadual di bawah menunjukkan perbezaan antara alkana dan alkena.
| Alkana | Alkena | |
|---|---|---|
| Formula am | CnH2n+2 | CnH2n |
| Jenis hidrocarbon | Tepu | Tidak tepu |
| Pembakaran | Sedikit jelaga | Lebih banyak jelaga |
| Tindak balas dengan cecair bromin | Tiada perubahan diperhatikan | Warna perang air bromin menjadi tidak berwarna |
| Tindak balas dengan kalium permanganat (VII) | Tiada perubahan diperhatikan | Warna ungu kalium permanganat (VII) menjadi tidak berwarna |
Sifat-sifat Kimia Alkena
- Alkena lebih reaktif daripada alkana dalam tindak balas kimia.
- Ini kerana alkena adalah hidrokarbon tak tepu yang mempunyai ikatan ganda dua, C=C, di antara dua atom karbon.
- Hampir semua tindak balas kimia alkena berlaku pada ikatan ganda dua ini..
- Alkenes boleh menjalani:
- Tindak balas pembakaran
- Tindak balas penambahan
- Tindak balas pempolimeran
Pembakaran Alkena
Pembakaran Alkena
- Seperti hidrokarbon lain, alkena terbakar dalam udara atau oksigen.
- Seperti alkana,
- Alkena terbakar lengkap dalam oksigen yang mencukupi untuk menghasilkan karbon dioksida dan air.
- Pembakaran alkena tidak lengkap dalam bekalan oksigen yang terhad untuk menghasilkan karbon monoksida, karbon (dalam bentuk jelaga) dan air.
Contoh
Pembakaran lengkap etena
Pembakaran tidak lengkap etena
Pembakaran alkena menjadi lebih sukar dan menghasilkan lebih banyak jelaga apabila saiz molekul alkena meningkat.
Peratus Karbon
Contoh
Cari dan bandingkan peratusan karbon etena, propene dan butena. [Jisim atom relatif: C = 12, H = 1]
Jawapan:
Peratus karbon etena (C2H4)
\[\begin{gathered}
{\text{Peratus karbon}} \hfill \\
{\text{ = }}\frac{{2\left( {{\text{12}}} \right)}}{{2\left( {{\text{12}}} \right){\text{ + 4}}\left( 1 \right)}} \times 100\% \hfill \\
= 85.7\% \hfill \\
\end{gathered} \]
Peratus karbon propena (C3H6)
\[\begin{gathered}
{\text{Peratus karbon}} \hfill \\
{\text{ = }}\frac{{3\left( {{\text{12}}} \right)}}{{3\left( {{\text{12}}} \right){\text{ + 6}}\left( 1 \right)}} \times 100\% \hfill \\
= 85.7\% \hfill \\
\end{gathered} \]
Peratus karbon butena (C4H8)
\[\begin{gathered}
{\text{Peratus karbon}} \hfill \\
{\text{ = }}\frac{{4\left( {{\text{12}}} \right)}}{{4\left( {{\text{12}}} \right){\text{ + 8}}\left( 1 \right)}} \times 100\% \hfill \\
= 85.7\% \hfill \\
\end{gathered} \]
Nota::
Semua alkenes mempunyai peratusan karbon yang sama.
Contoh
Cari dan bandingkan peratusan karbon heksana dan heksena.
[Jisim atom relatif: C = 12, H = 1]
Jawapan:
Peratus karbon keksana (C6H14)
\[\begin{gathered}
{\text{Peratus karbon}} \hfill \\
{\text{ = }}\frac{{6\left( {{\text{12}}} \right)}}{{6\left( {{\text{12}}} \right){\text{ + 14}}\left( 1 \right)}} \times 100\% \hfill \\
= 83.7\% \hfill \\
\end{gathered} \]
Peratus karbon heksena (C6H12) = 85.7% (rujuk kepada contoh di atas)
Nota:
- Peratusan karbon alkena lebih tinggi berbanding dengan alkana yang mempunyai bilangan karbon per molekul yang sama.
- Oleh itu, pembakaran alkena akan menghasilkan api yang lebih berjelaga berbanding dengan alkana yang setara.
- Alkena mempunyai peratusan karbon yang lebih tinggi berbanding dengan alkana yang setara.
Tindak Balas Penambahan
Tindak Balas Penambahan Alkena
- Alkena ialah hidrokarbon tak tepu, oleh itu ia boleh mengalami tindak balas penambahan.
- Tindak balas penambahan berlaku apabila atom-atom lain ditambah kepada atom karbon dalam ikatan ganda dua, -C=C- untuk membentuk satu ikatan kovalen tunggal.
Contoh,
Alkena boleh menjalani tindak balas penambahan dengan
- Halogen
- Stim
- Hidrogen
- Hidrogen halida
- Kalium permanganat (VII)
Penghidrogenan Alkena
- Alkena boleh bertindak balas dengan gas hidrogen.
- Proses ini juga dipanggil penghidrogenan.
Persamaan:
Nota:
- Tindak balas ini ialah satu tindak balas yang menukar hidrokarbon tak tepu kepada hidrokarbon tepu.
- Keadaan untuk tindak balas:
- Mangkin: Platinum / nikel
- Suhu: 180ºC
- Ini adalah proses yang digunakan untuk menghasil marjerin.
Tindak balas Alkena dengan Hidrogen Halida
Alkena bertindak balas dengan hidrogen halida (seperti hidrogen klorida, hidrogen bromida dan hidrogen iodida) pada suhu bilik untuk menghasilkan sebatian organik tepu yang dipanggil halogenoalkana.
Etena Bertindak dengan Hidrogen Klorida
Etena Bertindak dengan Hidrogen Bromida
Etena Bertindak dengan Hidrogen Iodida
Penghalogenan Alkena
- Alkena menjalani tindak balas penambahan dengan halogen seperti fluorin, klorin, bromin dan iodin.
- Oleh kerana ini adalah tindak balas dengan halogen, maka ia juga dikenali sebagai tindak balas penghalogenan.
- Persamaan di bawah menunjukkan tindak balas tambahan antara etena dan bromin.
- Apabila gas etena disalur ke dalam cecair bromin, warna perang bromin berubah menjadi tidak berwarna.
- Bahan yang dihasilkan ialah 1,2-dibromoethane.
- Jika gas klorin digunakan dan bukannya bromin, warna kuning air klorin akan dilunturkan.
Penghidratan Alkena
- Alkena boleh bertindak balas dengan stim (air) untuk menghasilkan alkohol.
- Proses ini merupakan tindak balas penambahan.
- Ia juga dikenali sebagai tindak balas penghidratan.
- Persamaan di bawah menunjukkan tindak balas penambahan etena dengan stim.
- Alkena berubah menjadi alkohol
- Keadaan tindak balas adalah seperti berikut:
- Pemangkin: Asid fosforik
- Suhu: 300ºC
- Tekanan: 60 atm
- Alkohol boleh diubah kembali kepada alkena melalui tindak balas pendehidratan.
Pengoksidaan Alkena
- Alkena juga boleh bertindak balas dengan agen pengoksida seperti kalium permanganate (VII) untuk menghasilkan diol.
- Diol adalah alkohol dengan 2 kumpulan hidroksil (-OH).
- Proses ini merupakan tindak balas penambahan.
- Persamaan kimia di bawah menunjukkan tindak balas pengoksidaan (juga tindak balas penambahan) antara etena dan kalium permanganat (VII).
- Dalam tindak balas ini, kita menggunakan simbol [O], untuk mewakili agen pengoksidaan.
- Bahan yang dihasilkan adalah etan-1,2-diol.
- Semasa tindak balas, warna ungu larutan kalium manganate (VII) berasid berubah menjadi tidak berwarna.
Pempolimeran
- Pempolimeran ialah proses menggabungkan molekul monomer dalam tindak balas kimia untuk membentuk rantai polimer yang panjang.
- Molekul alkena boleh bergabung bersama melalui tindak balas penambahan untuk membentuk polimer rantaian panjang.
- Dalam tindak balas, molekul alkena menjalani tindak balas penambahan pada suhu 200 ° C dan tekanan 1200 atm.
- Beribu-ribu molekul alkena bergabung bersama untuk membentuk molekul rantaian panjang dipanggil poli (etena) – biasanya dipanggil politena.
Membandingkan Rintangan di Dalam Litar Bersiri/Selari/Bergabung
- Dalam litar bersiri, semakin banyak perintang dengan rintangan yang sama dalam litar, semakin tinggi rintangan berkesan litar itu.

- Dalam litar selari, semakin banyak perintang dengan rintangan yang sama dalam litar, semakin rendah rintangan berkesan litar itu.

Sifat-sifat Fizik Alkena
- Alkena ialah sebatian kovalen yang terdiri daripada molekul-molekul ringkas.
- Molekul-molekul alkena ditarik oleh daya tarikan Van der Waals yang lemah (daya intermolekul).
- Sebagai sebatian kovalen, sifat-sifat fizik alkena adalah serupa dengan alkana.
Takat Didih
Penting!
3 alkena pertama adalah gas.
Takat lebur dan takat didih meningkat apabila bilangan karbon per molekul meningkat. (Anda juga mesti tahu penerangannya).
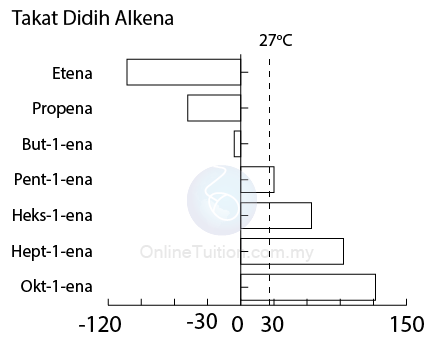
- Alkena mempunyai takat lebur dan takat didih yang rendah, disebabkan daya intermoleku yang lemah.
- Pada suhu bilik, etena, propena dan butena wujud sebagai gas manakala pentena ke dekena wujud sebagai cecair.
- Seperti yang ditunjukkan dalam rajah di bawah, takat didih alkena meningkat apabila bilangan atom karbon per molekul meningkat.
- Ini kerana apabila bilangan atom karbon per molekul bertambah, saiz molekul meningkat, dengan itu daya antara molekul meningkat.
- Akibatnya, tenaga haba yang lebih banyak diperlukan untuk mengatasi daya ini semasa lebur dan mendidih, dan oleh itu kenaikan dan titik didih meningkat.
Takat Didih Alkena Berbanding Dengan Alkana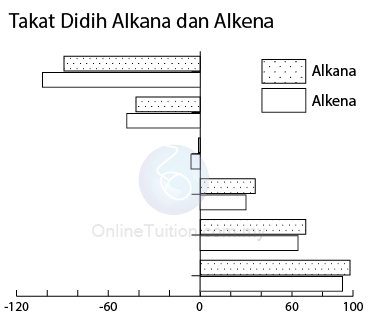
- Seperti yang ditunjukkan dalam gambar di atas, alkena mempunyai takat didih yang lebih rendah daripada alkana yang mempunyai bilangan karbon yang sama dalam molekulnya.
- Ini kerana alkena mempunyai bilangan elektron yang kurang bagi setiap molekul berbanding dengan alkana yang setara (yang mempunyai bilangan karbon yang sama bagi satu molekul).
- Akibatnya, daya intermolekul dalam alkena lebih rendah daripada alkana yang setara.
Penting!
Kekuatan daya Van der Waals bergantung kepada bilangan elektron dan bentuk molekul. Lebih banyak elektron → Kekuatan daya Van der Waals lebih kuat
Mesti Tahu!
Alkena mempunyai takat didih yang lebih rendah berbanding dengan alkana yang mempunyai bilangan karbon yang sama dalam molekulnya.
Keterlarutan dan Konduksian
- Sama seperti kebanyakan sebatian kovalen yang lain, alkena tidak larut dalam air tetapi larut dalam pelarut organik.
- Alkena tidak mengkonduksikan elektrik kerana tidak mempunyai ion-ion bergerak bebas di dalamnya.
Ketumpatan
- Ketumpatan alkena adalah rendah (lebih rendah daripada air).
- Bagaimanapun, ketumpatan alkena meningkat apabila bilangan atom karbon per molekul meningkat.