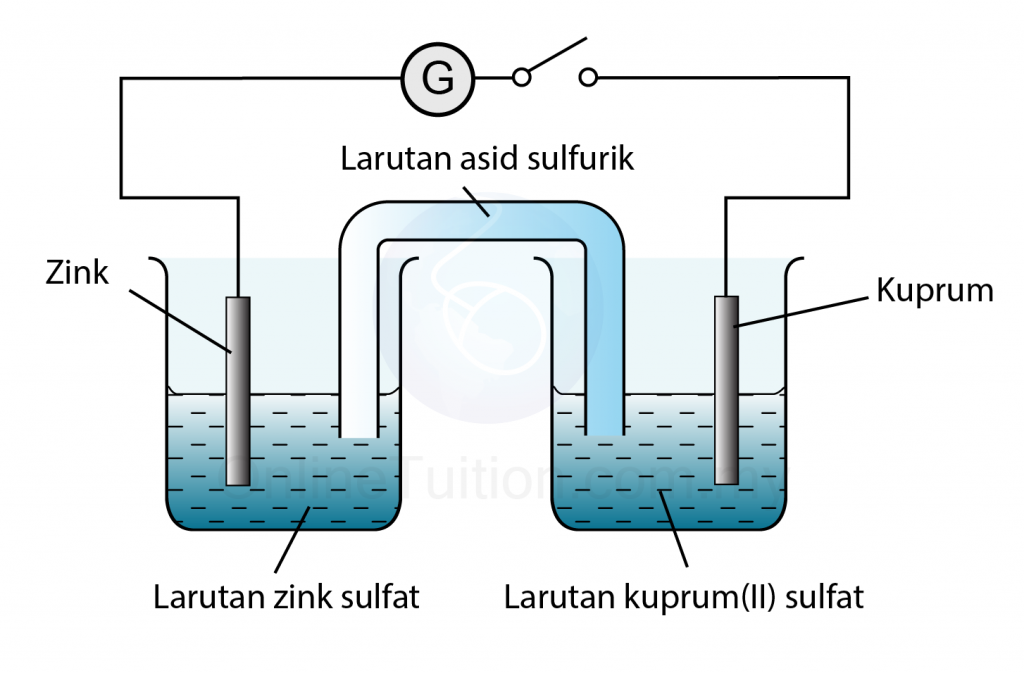
- Sebuah sel kimia ringkas terdiri daripada dua jalur logam berlainan yang dicelup ke dalam elektrolit. Dua logam ini disambung melalui litar luar oleh wayar penyambung. Logam-logam ini bertindak sebagai elektrod.
- Logam yang berada di kedudukan yang lebih tinggi dalam siri elektrokimia akan membebaskan elektron dan seterusnya bertindak sebagai terminal negatif.
- Logam yang berada di kedudukan yang lebih rendah pula bertindak sebagai terminal positif.
Contoh: Sel ringkas Zink-Kuprum
Di Anod:
Zink yang lebih elektropositif memlepaskan elektron dan bertindak sebagai terminal negatif.
Persamaan setengah:
Pemerhatian:
Logam zink menjadi lebih nipis.
Di Katod
Kuprum yang kurang elektropositif menerima elektron dan bertindak sebagai terminal positif.
lon kuprum(II) dari kuprum(II) sulfat menerima elektron dan membentuk logam kuprum.
Persamaan setengah:
Pemerhatian:
Logam kuprum menjadi lebih tebal.
Nota:
Elektron mengalir dari terminal negatif ke terminal positif. Arus elektrik dihasilkan daripada pengaliran electron dari terminal positif ke terminal negatif.
Di Anod
Magnesium berada di kedudukan yang lebih tinggi di dalam siri elektrokimia. Oleh itu, ia akan membebaskan elektron dan bertindak sebagai elektron negatif.
Persamaan setengah
Atom magnesium membebaskan 2 elektron dan membentuk ion magnesium..
Mg → Mg2+ + 2e
Pemerhatian
Jalur magnesium menjadi semakin nipis.
Di Katod
Elektron-elektron yang dibebaskan di anod mengalir ke elektrod kuprum dan menyahcaskan ion-ion positif yang terkumpul disekitar elektrod.
Tindakbalas Kimia
Ion-ion positif yang hadir di sekitar katod ialah ion magnesium dan ion hydrogen. Hydrogen berada di kedudukan yang lebih rendah di dalam siri elektrokimia. Oleh yang demikian, ion-ion hidrogen dipilih untuk dinyahcaskan. Ion-ion hydrogen menerima elektron dan membentuk molekul hidrogen.
2H+ + 2e → H2
Pemerhatian
Gas tidak berwarna terhasil di sekitar elektrod kuprum. Gas ini menghasilkan bunyi “pop” apabila terdedah kepada kayu uji menyala.