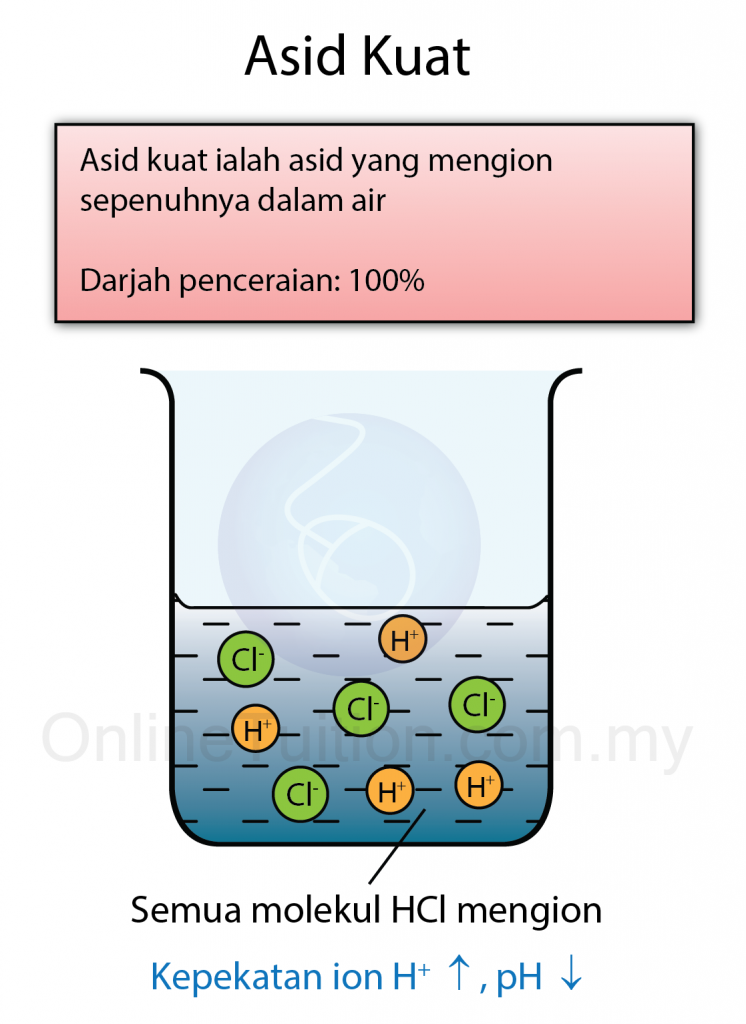
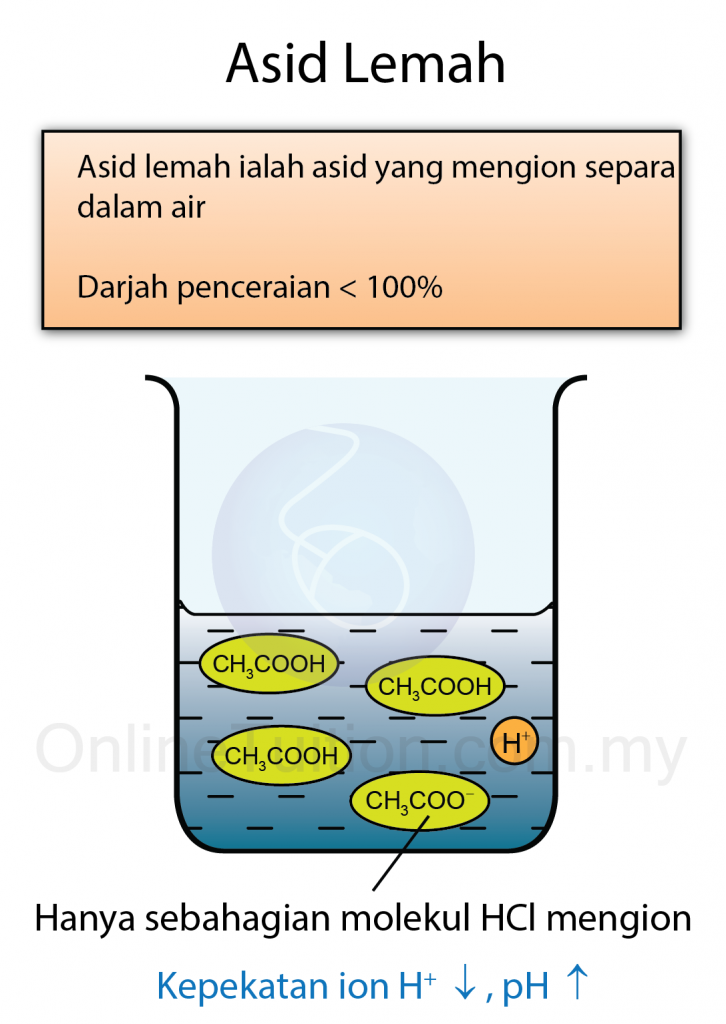
Tekanan yang dihasilkan oleh cecair mempunyai ciri-ciri berikut:
- Tekanan cecair yang bertindak ke atas suatu objek tidak bergantung kepada
Tekanan Bertambah Dengan Kedalaman
- Rajah di atas menunjukkan suatu tin kosong yang mempunyai tiga lubang kecil. air yang keluar dari lubang paling bawah terpancut ke jarak yang paling jauh. Ini berlaku kerana ia terletak di titik yang paling dalam. Iaitu, semakin dalam dari permukaan air, semakin jauh air dipancut keluar.
- Kesimpulannya, semakin dalam dari permukaan cecair, tekanan semakin meningkat.
Tekanan Cecair Bergantung Kepada Ketinggian Menegak Cecair tetapi Bukan Panjang Turus Cecair
Tekanan di A = Tekanan di B
Tekanan Cecair Adalah Sama Di Semua Titik Yang Berada Pada Aras/Kedalaman Yang Sama
Aras air di dalam satu bekas adalah sentiasa sama kerana bagi satu cecair, tekanan sentiasa sama pada aras/kedalaman yang sama.
Tekanan Cecair Tidak Bergandung Kepada Jumlah Luas Permukaan Objek
Tekanan yang dikenakan ke atas ikan kecil
= Tekanan yang dikenakan ke atas ikan besar
Tekanan Bertindak ke Semua Arah.
Tekanan pada satu titik di dalam cecair bertindak ke semua arah dengan manitud yang sama.