Sifat-sifat Kimia Alkana
Kereaktifan Alkana
- Alkana ialah hidrokarbon yang tepu yang mempunyai ikatatan (C – C) yang kuat.
- Alkana tidak begitu reaktif jika dibandingkan dengan hidrokarbon yang tidak tepu seperti alkena.
- Alkana bersifat neutral dan tidak menukarkan warna kertas litmus biru/ merah lembab.
- Semua ikatan kimia di dalam alkana ialah ikatan kovalen yang kuat. Untuk memecahkan ikatan ini banyak tenaga diperlukan.
- Alkana hanya boleh menjalankan tindak balas berikut:
- Tindak balas pembakaran
- Tindak balas penukargantian ( dengan kehadiran sinaran ultraungu)
Tindak Balas Pembakaran
Pembakaran Alkana
- Semua alkana boleh terbakar dengan kehadiran oksigen menghasilkan air dan karbon dioksida (atau karbon monoksida/ karbon dalam pembakaran tidak lengkap)
- Terdapat 2 jenis pembakaran
- Pembakaran lengkap
- Pembakaran tidak lengkap
- Dalam udara/oksigen yang berlebihan, semua alkana terbakar dengan lengkap dan menghasilkan karbon dioksida dan air.
- Pembakaran alkana yang lengkap ini membebaskan banyak tenaga haba.
- Berikut ialah persamaan kimia bagi pembakaran lengkap beberapa jenis alkana.
Contoh:
Pembakaran metana
CH4 + 2O2 → CO2 + 2H2OPembakaran etanaC2H6 + 7/2 O2 → 2CO2 + 3H2OPembakaran propanaC3H8 + 5O2 → 3CO2 + 4H2O
- Nyalaan pembakaran alkana menjadi semakin berjelaga apabila bilangan atom karbon per molekul meningkat. Ini disebabkan oleh peratus kandungan karbon dalam alkana yang bertambah.
Pembakaran Tidak Lengkap
- Pembakaran tidak lengkap berlaku jika bekalan oksigen tidak memcukupi.
- Dalam keadaan oksigen yang tidak mencukupi, alkana terbakar dengan nyalaan yang sangat berjelaga dan menghasilkan karbon ( pepejal hitam ) , gas karbon monoksida dan air.
- Gas karbon monoksida ialah sejenis gas tidak berbau yang beracun.
- Berikut ialah persamaan-persamaan kimia bagi pembakaran tidak lengkap beberapa jenis alkana.
Contoh:
Pembakaran tidak lengkap etanaC2H6 + 5/2 O2 → 2CO + 3H2OC2H6 + 3/2 O2 → 2C + 3H2OPembakaran tidak lengkap propana
C3H8 + 7/2 O2 → 3CO + 4H2OC3H8 + 2 O2 → 3C + 4H2O - Apabila sesuatu alkana terbakar dengan tidak lengkap, nyalaan pembakarannya lebih berjelaga kerana sebahagian besar alkana terbakar untuk menghasilkan karbon dalam bentuk asap hitam.
Nota penting!
Cukup oksigen → Pembakaran lengkap
Tak cukup oksigen → Pembakaran tidak lengkap
Cukup oksigen → Pembakaran lengkap
Tak cukup oksigen → Pembakaran tidak lengkap
—————————-
Pembakaran lengkap menghasilkan CO2 dan H2O
Pembakaran tidak lengkap menghasilkan C, CO dan H2O
Pembakaran tidak lengkap menghasilkan C, CO dan H2O
—————————-
Semakin besar molekul alkana, semakin susah ia dibakar.
Peratus Karbon
- Dalam pembakaran alkana, kuantiti jelaga yang dihasilkan bergantung kepada peratus karbon dalam molekul hidrokarbon itu.
- Peratus karbon di dalam satu molekul boleh dikira dengan menggunakan formula berikut:
\[\begin{gathered}
{\text{Peratus Karbon}} \hfill \\
{\text{ = }}\frac{{{\text{Jisim relatif karbon dalam 1 molekul}}}}{{{\text{Jisim molekul relatif alkana}}}} \times 100\% \hfill \\
\end{gathered} \] - Berikut ialah contoh pengiraan peratus karbon dalam metana dan heksana.
- peratus karbon metana (CH4) [Jisim atom relatif: Karbon: 12; Hidrogen: 1]
\[\begin{gathered}
{\text{Peratus karbon}} \hfill \\
{\text{ = }}\frac{{{\text{12}}}}{{{\text{12 + 4}}\left( 1 \right)}} \times 100\% \hfill \\
= 75\% \hfill \\
\end{gathered} \] - Peratus karbon heksana (C6H14)
\[\begin{gathered}
{\text{Percentage of Carbon}} \hfill \\
{\text{ = }}\frac{{6\left( {{\text{12}}} \right)}}{{6\left( {{\text{12}}} \right){\text{ + 14}}\left( 1 \right)}} \times 100\% \hfill \\
= 83.7\% \hfill \\
\end{gathered} \] - Peratus karbon dalam heksana lebih tinggi daripada metana, oleh itu pembakaran hak sana menghasilkan lebih banyak jelaga.
Nota penting!
Semakin besar molekul sesuatu alkana, semakin tinggi peratus karbonnya, maka semakin banyak jelaga dihasilkan semasa pembakaran.
Tindak Balas Penukar Gantian
Tindak balas penukargantian
- Apabila satu campuran alkana dan gas klorin didedahkan kepada cahaya matahari atau cahaya ultraungu, suatu tindak balas berlaku dengan perlahan-lahan di mana atom hidrogen dalam molekul alkana ditukargantikan oleh atom klorin satu demi satu.
- Tindak balas alkana dengan klorin ini dikenal sebagai tindak balas penukargantian.
- Misalnya, apabila satu campuran gas metana dan klorin berlebihan didedahkan kepada cahaya matahari/ ultraungu, tindak balas penukargantian secara berturut-turut berlaku melalui empat peringkat seperti yang ditunjukkan di bawah:
- Tindak balas penukargantian juga berlaku di antara alkana dan cecair bromin
- Oleh kerana tindak balas penukargantian ialah tindak balas di antara alkana dengan unsur-unsur halogen, maka ia juga dinamakan sebagai tindak balas penghalogenan.
- Tindak balas Penukargantian ialah satu tindak balas yang perlahan.
Nota penting!
Tindak balas penukargantian di antara alkana dan halogen hanya berlaku dengan kehadiran sinaran ultraungu.

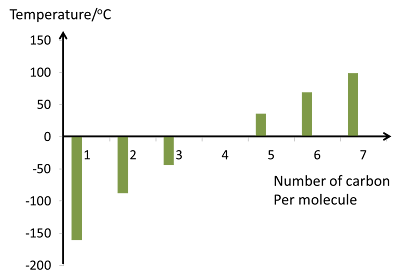



 Hidrokarbon tepu ialah hidrokarbon di mana semua atom karbonnya diikat oleh ikatan tunggal sahaja. Contohnya, alkana.
Hidrokarbon tepu ialah hidrokarbon di mana semua atom karbonnya diikat oleh ikatan tunggal sahaja. Contohnya, alkana.





