Kekuatan asid
- Kekuatan asid dan alkali bergantung pada darjah pengionan asid dan alkali dalam air.
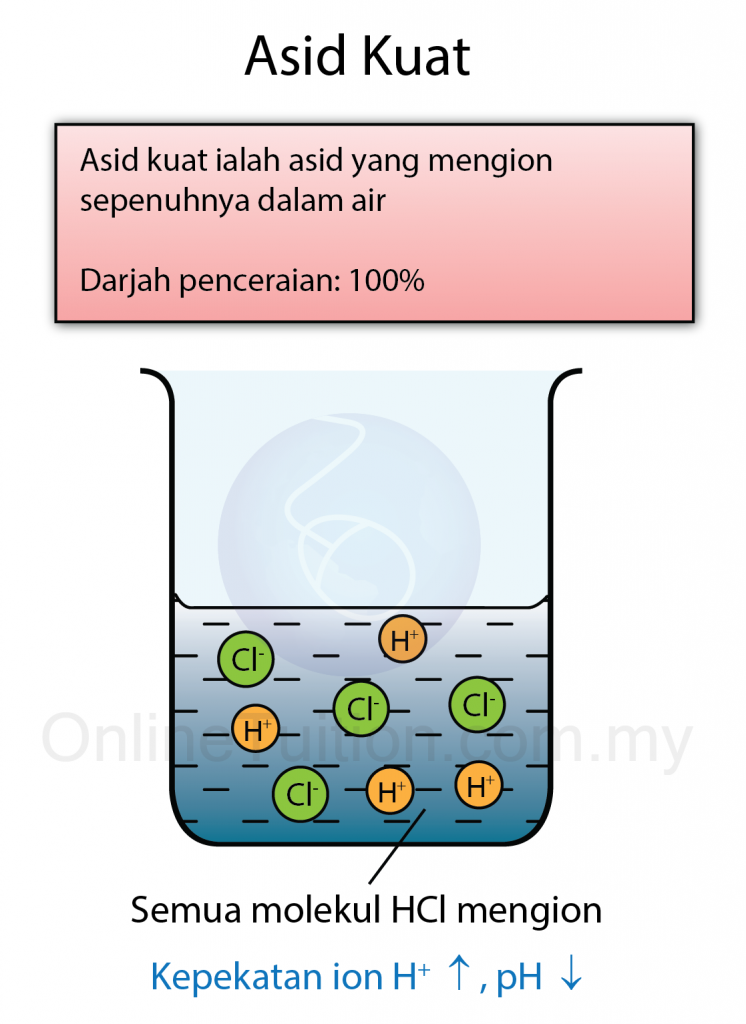
- Asid kuat ialah asid yang mengion sepenuhnya dalam air menghasilkan kepekatan ion hidrogen, H+ yang tinggi.
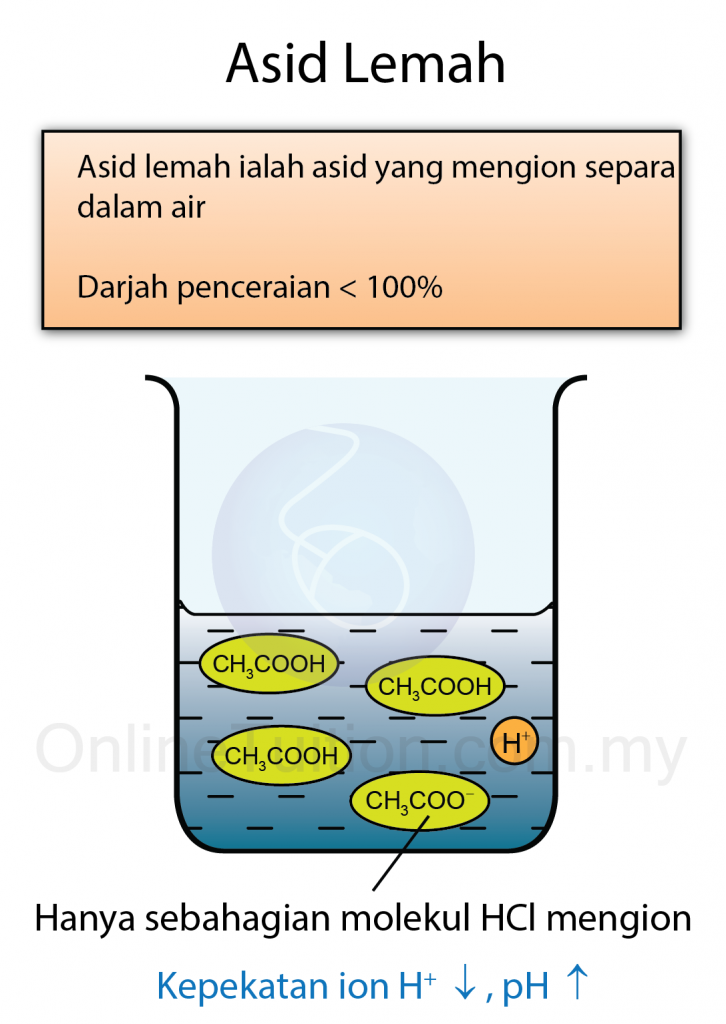
- Asid lemah ialah asid yang mengion separa dalam air menghasilkan kepekatan ion hidrogen, H+ yang rendah.
| Asid | Kepekatan | Darjah penceraian |
| Asid hidroklorik | 0. 1 Mol dm-3 | 100% |
| Asid etanoik | 0. 1 mol dm-3‘ | 1.34% |
- Dalam jadual di atas, kedua-dua asid hidroklorik dan asid etanoik mempunyai kepekatan yang sama.
- Bagaimanapun, darjah penceraian asid hidroklorik ialah 100% manakala darjah penceraian asid etanoik hanya 1.34%.
- Asid hidroklorik mengion sepenuhnya dalam air menghasilkan kepekatan ion hidrogen H+ yang tinggi. Maka ia dikelaskan sebagai asid kuat.
- Asid etanoik hanya mengion separa dalam air, menghasilkan kepekatan ion hidrogen, H+ yang rendah. Oleh itu ia dikelaskan sebagai asid lemah.
- Dalam larutan akueus asid lemah, kebanyakan daripada asid lemah itu masih kekal dalam bentuk molekul-molekul kovalen dan sedikit sahaja bilangan molekul asid bercerai membentuk ion-ion.
- Contoh-contoh asid kuat
- asid sulfurik
- asid hidroklorik
- asid nitrik
- Contoh-contoh asid lemah
- asid etanoik
- asid sulfurus
- asid fosforik
- asid karbonik
Kekuatan Alkali
- Alkali kuat ialah alkali yang mengion sepenuhnya dalam air menghasilkan kepekatan ion hidroksida, OH– yang tinggi.
- Alkali lemah ialah alkali yang mengion separa dalam air menghasilkan kepekatan ion hidroksida, OH– yang rendah.
- Contoh-contoh alkali kuat
- natrium hidroksida
- kalium hidroksida
- barium hidroksida
- kalsium hidroksida
- Contoh-conroh alkali lemah
- Ammonia
- natrium hidrogen karbonat