Contoh 1:
Rajah di atas menunjukkan satu manometer yang mengandungi merkuri disambung kepada satu tangki yang diisi oleh cecair dan gas metana. Cari tekanan gas dalam unit cmHg and Pa.
[Ketumpatan merkuri = 13.6 x 10³ kg/m³; tekanan atmosfera = 76 cmHg]
Jawapan:
Tekanan gas dalam cmHg
P = 20 + 76 = 96 cmHg
Tekanan gas dalam Pa
Tekanan atmosfera,
Tekanan gas,


 (Tindak balas peneutralan digunakan untuk mengubah pH tanah)
(Tindak balas peneutralan digunakan untuk mengubah pH tanah)



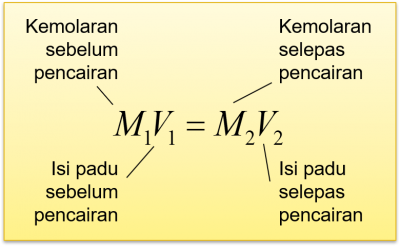
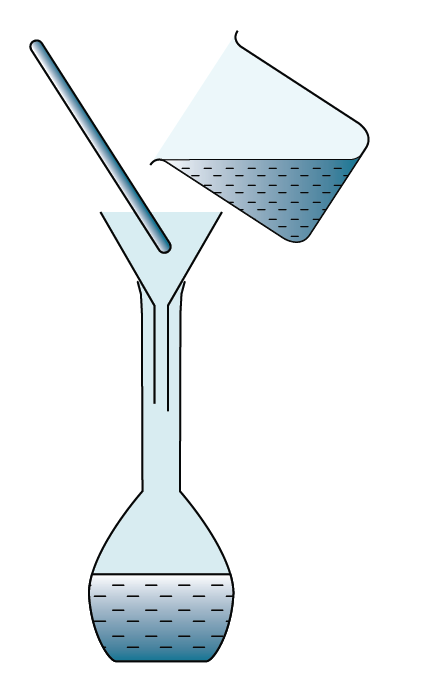
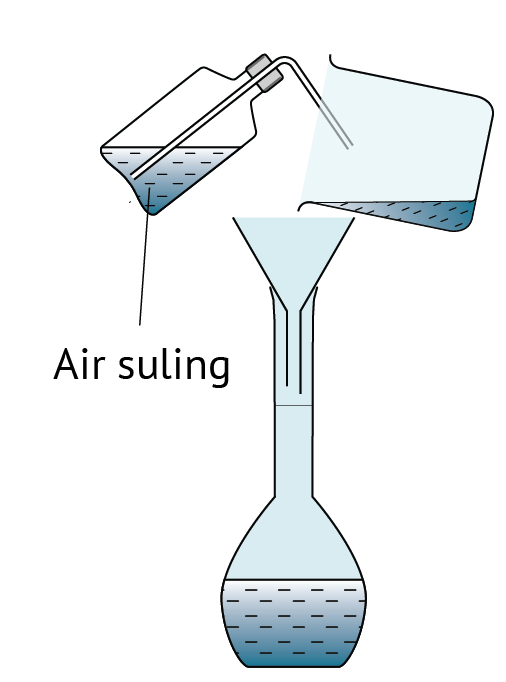
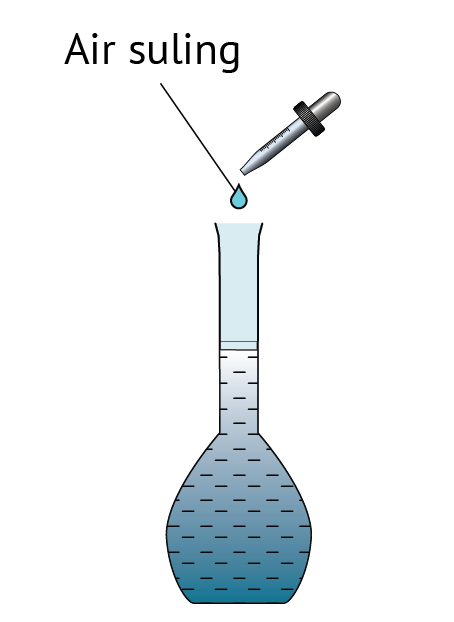
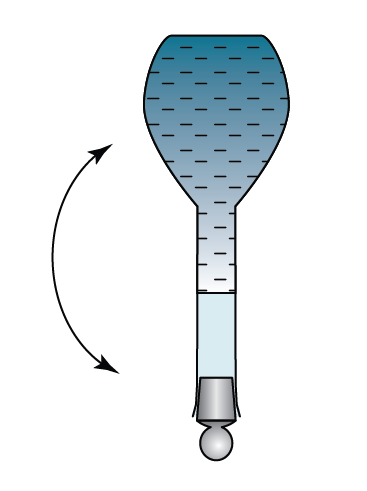


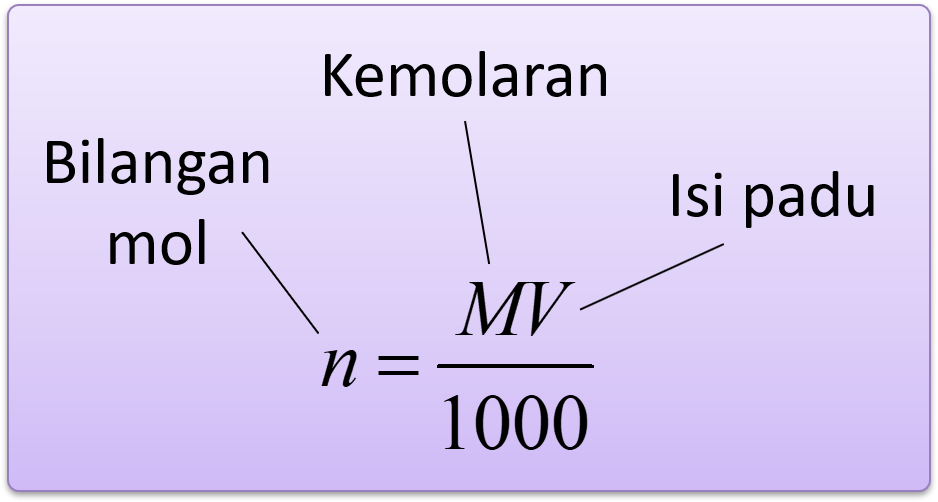 Dalam rumus di atas, unit isi padu ialah cm3.
Dalam rumus di atas, unit isi padu ialah cm3.