Pentitratan Asid-Bes
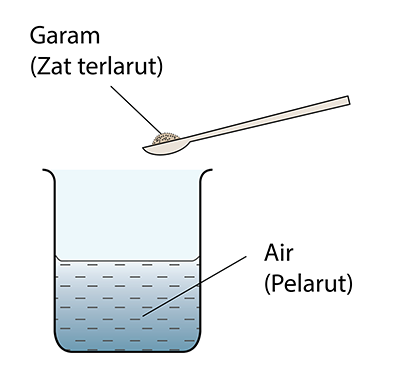
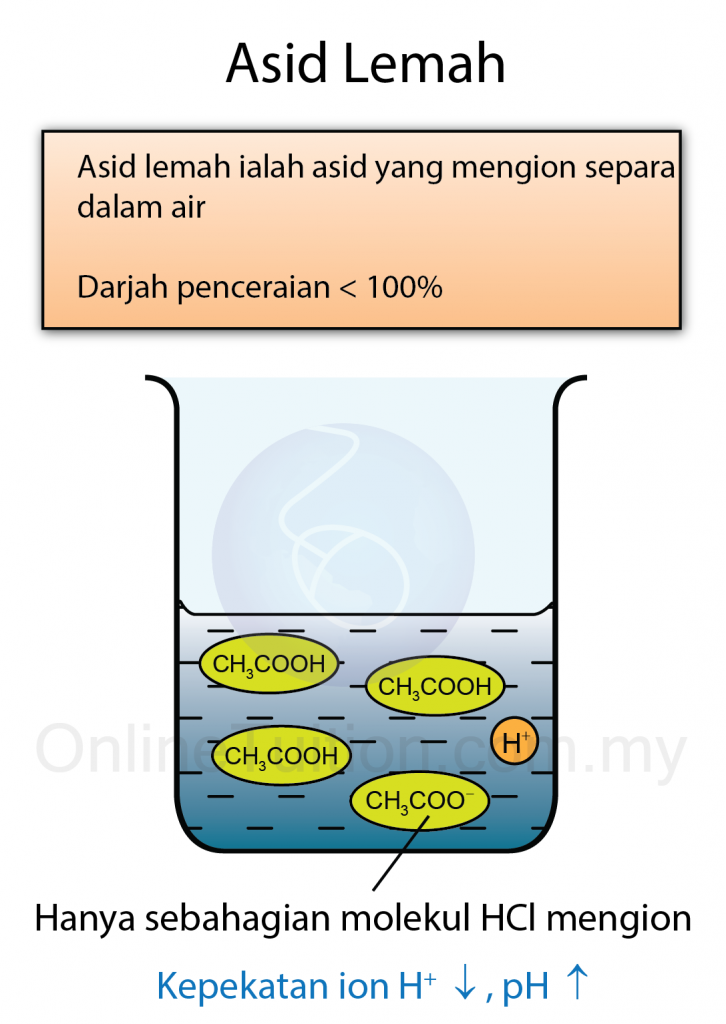
- Pentitratan ialah teknik yang digunakan untuk menentukan isi padu asid yang diperlukan untuk meneutralkan isi padu tertentu alkali dengan bantuan penunjuk asid-bes.
- Penunjuk yang biasa digunakan adalah fenolftalein dan metil jingga.
- Langkah-langkah yang diambil adalah :
- Isi padu tepat alkali yang disukat dengan pipet.
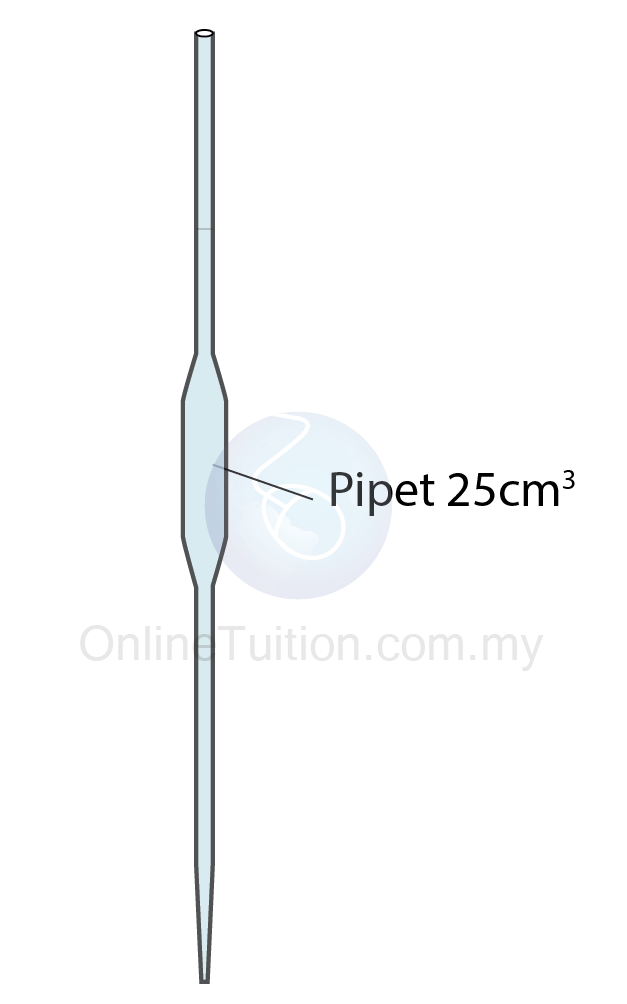
- Alkali dituang ke dalam kelalang kon.
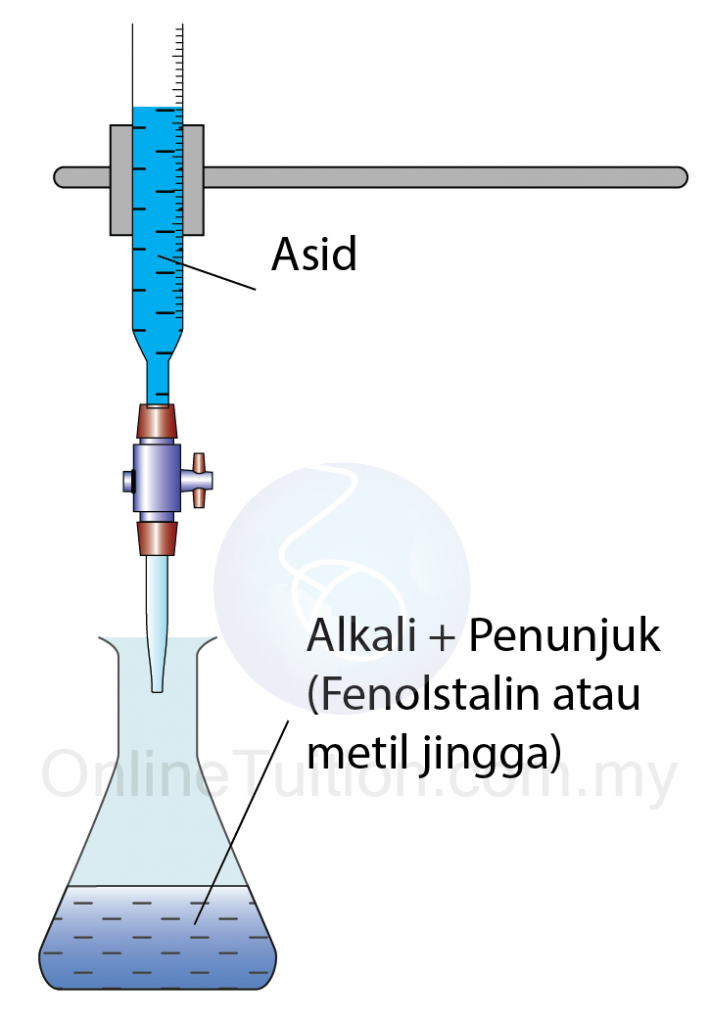
- Beberapa titik penunjuk ditambah ke dalam alkali itu.
- Buret diisi dengan asid.
- Asid ditambah titis demi titis ke dalam alkali dalam kelalang kon sehingga warna penunjuk bertukar.
- Isi padu tepat alkali yang disukat dengan pipet.
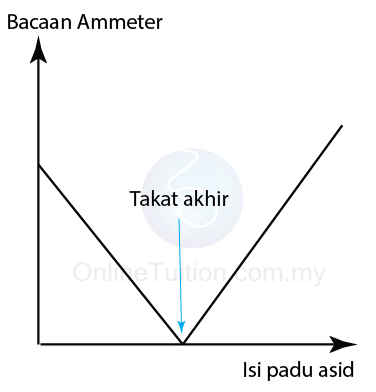
- Apabila asid sudah meneutralkan kauntiti alkali yang diberi dengan lengkap , pentitratan telah mencapai takat akhir.
- Takat akhir ialah takat dalam pentitratan di mana penunjuk bertukar warna.
- Selain penunjuk asid-bes, meter pH juga biasa digunakan dalam pentitratan.
- Meter pH merekodkan perubahan nilai pH larutan terhasil semasa peneutralan kemudian diplot dalam graf.
- Selain daripada itu, sel konduksi juga digunakan untuk menentukan takat akhir pentitratan.
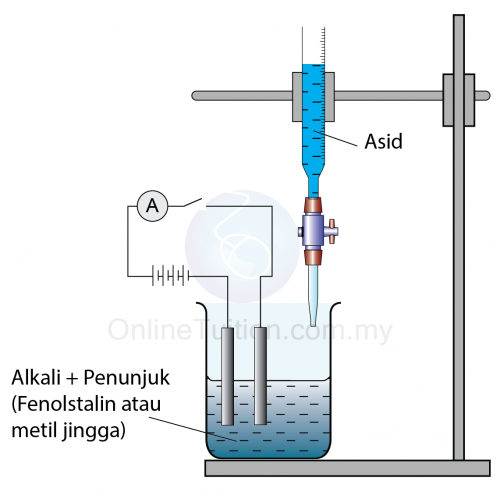 (Sel konduksi)
(Sel konduksi) - Rajah di bawah menunjukkan graf bacaan ammeter sel konduksi melawan isi padu asid dititiskan ke dalam alkali. Takat akhir boleh ditentukan.
 (Tindak balas peneutralan digunakan untuk mengubah pH tanah)
(Tindak balas peneutralan digunakan untuk mengubah pH tanah)
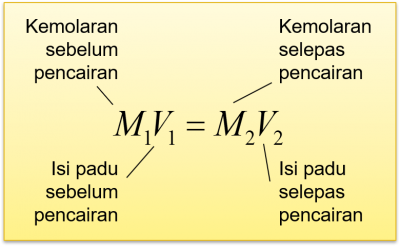
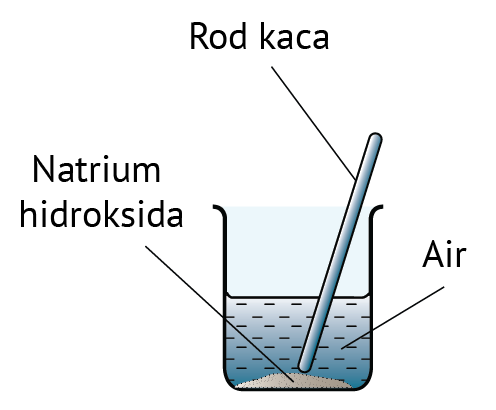
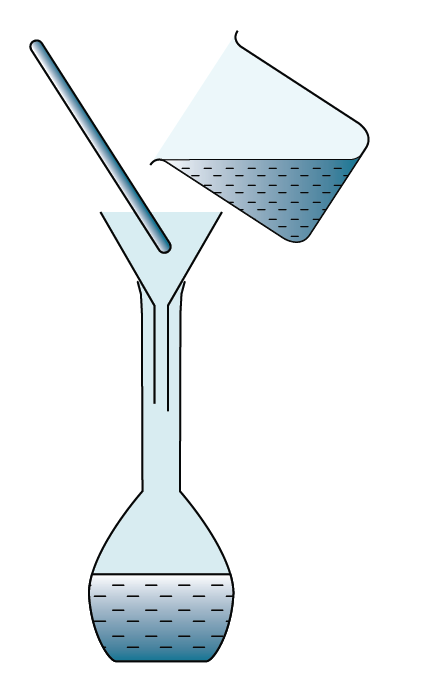
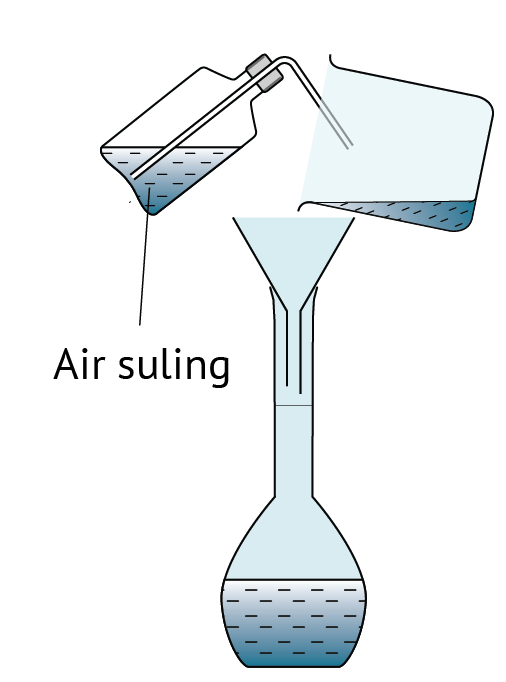
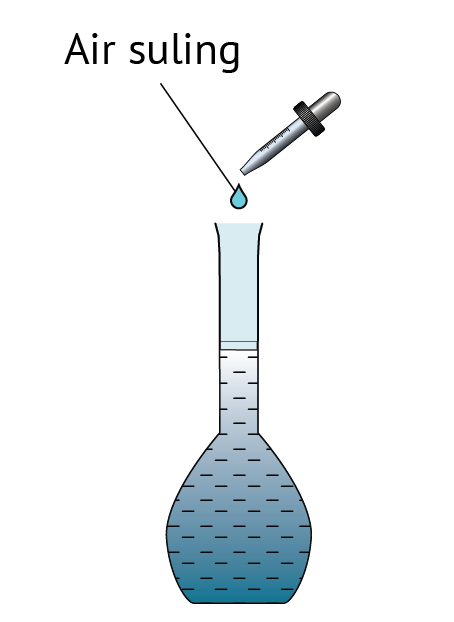
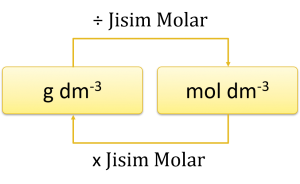
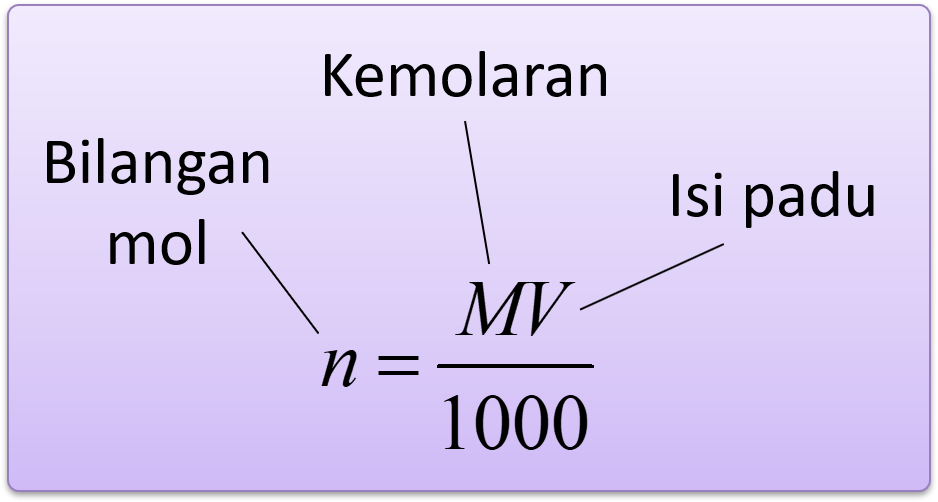 Dalam rumus di atas, unit isi padu ialah cm3.
Dalam rumus di atas, unit isi padu ialah cm3.