Tindak Balas Dengan Bes
- Asid bertindak balas dengan bes (oksida logam dan hidroksida logam) untuk membentuk garam dan air.
- Contoh
Asid Nitrik + Kuprum(II) Oksida2HNO3 + CuO → CU(NO3)2 + H2O
Contoh Eksperimen
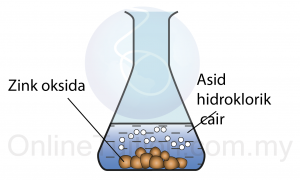
- 100cm3 asid sulfurik cair dimasukkan ke dalam kelalang kon.
- Beberapa ketul zink oksida dimasukan ke dalam asid tersebut.
- Campuran dikacau dengan rod kaca.
Pemerhatian
Pepejal putih zink oksida terlarut di dalam asid.
Perbincangan
Zink oksida bertindak balas dengan asid hidroklorik membentuk garam dan air.
ZnO + 2HCl → ZnCl2 + H2O
Tindak Balas Dengan Logam
- Semua asid bertindak balas dengan logam reaktif ( logam-logam yang lebih elektropositif daripada hidrogen dalam Siri Elektrokimia) seperti aluminium magnesium zink ferum untuk membebaskan gas hidrogen.
- Contoh
Magnesium + Asid HidroklorikMg + HCl → MgCl2 + H2
Aluminium + Asid SulfurikAl + H2SO4 → Al2(SO4)3 + H2
Ferum + Asid NitrikFe + HNO3 → Fe(NO3)2 + H2
- Ini ialah sejenis tindak balas penyesaran. Logam-logamdi atas hidrogen dalam Siri Elektrokimia
boleh menyesarkan hidrogen daripada asid. - Logam kurang reaktif seperti kuprum dan argentum tidak bertindak balas dengan asid.
- Bagaimanapun, kuprum bertindak balas dengan asid nitrik pekat.
Contoh Eksperimen
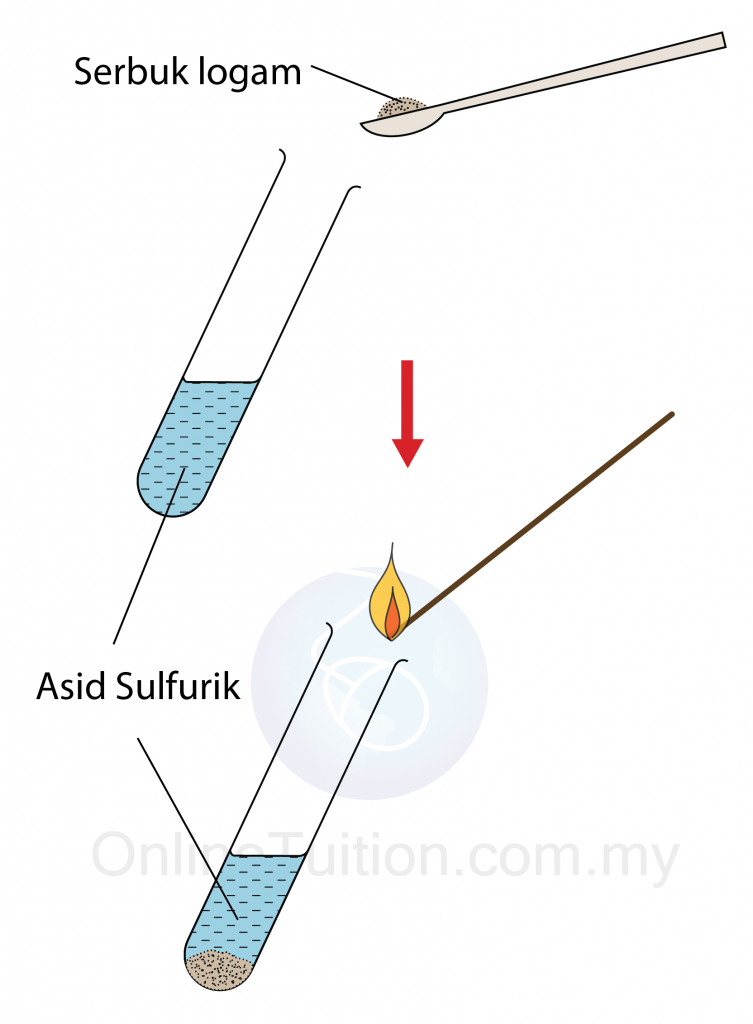
- 5 cm3 asid sulfurik cair dimasukkan ke dalam tabung uji.
- Satu spatula serbuk magnesium ditambah kepada asid.
- Kayu uji menyala diletakkan pada mulut tabung uji.
Pemerhatian
- Pepejal kelabu terlarut.
- Gelembung gas dibebaskan.
- Apabila kayu uji menyala didekatkan pada mulut tabung uji, bunyi ‘pop’ dihasilkan.
Perbincangan
- Magnesium bertindak balas dengan asid hidroklorik.
Mg + H2SO4 → MgSO4 + H2 - Gas hidrogen terbebas.
Tindak Balas Dengan Karbonat Logam
- Asid bertindak balas dengan karbonat logam seperti kalsium karbonat untuk membebaskan gas karbon dioksida
- Contoh
Kalsium Karbonat + Asid Hidroklorik
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
Contoh Eksperimen
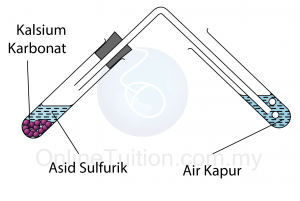
- Sebanyak 5 cm3 asid sulfurik cair dimasukkan ke dalam tabung uji.
- Satu spatula serbuk kalsium karbonat dimasukkan ke dalam asid.
- Gas yang dibebaskan dilalukan melalui air kapur seperti ditunjukkan dalam rajah.
Pemerhatian
- Pepejal putih terlarut.
- Gelembung gas terbebas. Apabila gas tersebut dilalukan melalui air kapur, air kapur menjadi keruh.
Perbincangan
- Kalsium karbonat bertindak balas dengan asid sulfurik menghasilkan garam kalsium sulfat, gas karbon dioksida dan air.
CaCO3 + H2SO4 → CaCl2 + H2O + CO2 - Gas karbon dioksida terbebas.








