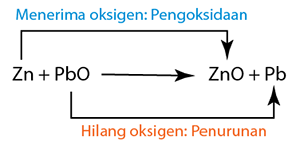
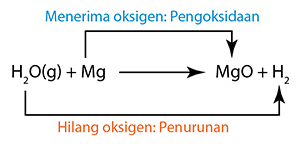
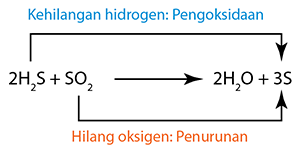
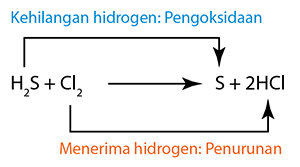
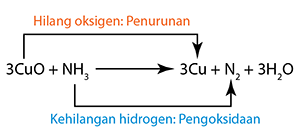
Tindak balas redoks yang dikaji di dalam silibus SPM termasuk
- Tindak balas redoks melibatkan ion ferum(II) dan ion ferum(III)
- Tindak balas redoks melibatkan penyesaran logam daripada larutan garam
- Tindak balas redoks melibatkan penyesaran halogen daripada larutan garam
- Tindak balas redoks melibatkan pemindahan elektron pada suatu jarak
- Pengaratan sebagai suatu tindak balas redoks
Agen Pengoksidaan dan Agen Penurunan
- Dalam tindak balas redoks, sebatian yang diturunkan ialah agen pengoksida. Ajen pengoksida adalah bahan yang mengoksidakan sesuatu bahan yang lain.
- Sebaliknya, sebatian yang teroksida adalah agen penurunan. Agen penurunan menurunkan sesuatu bahan yang lain.
Contoh:
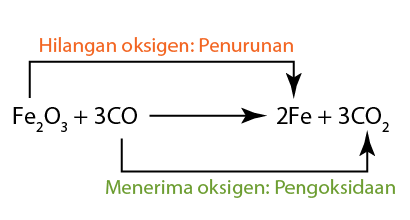
- ]Dalam tindak balas ini, ferum(III) oksida diturunkan. Oleh itu ia adalah agen pengoksida. Ia telah mengoksidakan karbon monoksida kepada karbon dioksida.
- Karbon monoksida teroksida. Oleh itu ia berfungsi sebagai agen penurunan. Ia telah menurunkan ferum(III) oksida untuk menjadi logam besi.
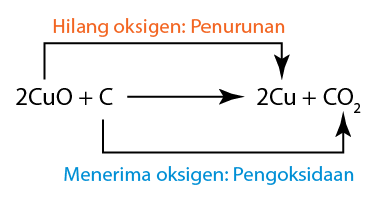
Contoh:
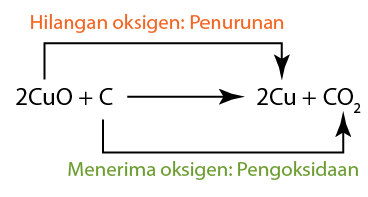
- Kuprum(II) oksida diturunkan, oleh itu ia adalah agen pengoksidaan.
- Karbon mengalami pengoksidaan, oleh itu ia adalah agen penurunan.
Agen Pengoksidaan/Penurunan Yang Biasa Digunakan
Berikut adalah agen pengoksidaan dan pengurangan yang biasa digunakan
Agen Pengoksidaan
Kalium Permanganat(VII) berasid
MnO4– + 8H+ + 5e → Mn2+ + 4H2O
Pemerhatian: Warna ungu kalium permanganat (VII) dilunturkan
Kalium dikromat(VI) berasid
Cr2O72- + 14H+ + 6e → 2Cr3+ + 7H2O
Pemenrhatian: Warna jingga kalium dikromat(VI) bertukar menjadi hijau.
Hidrogen peroksida
H2O2 + 2H+ + 2e → 2H2O
Asid nitrik pekat
NO3– + 4H+ + 3e → NO + 2H2O
Agen Penurunan
Sulfur Dioksida
SO2 + 2H2O → SO42- + 4H+ + 2e
Hidrogen Sulfida
H2S → 2H+ + S + 2e
Larutan Natrium Sulfit
SO32- + H2O → SO42- + 2H+ + 2e
Larutan Stanum(II) Klorida
Sn2+ → Sn4+ + 2e
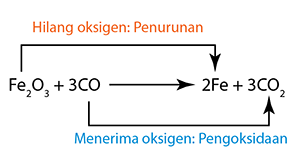
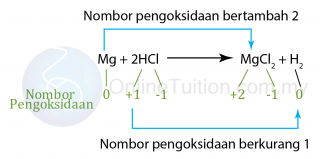
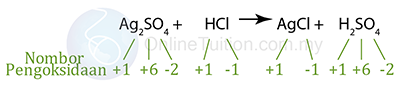
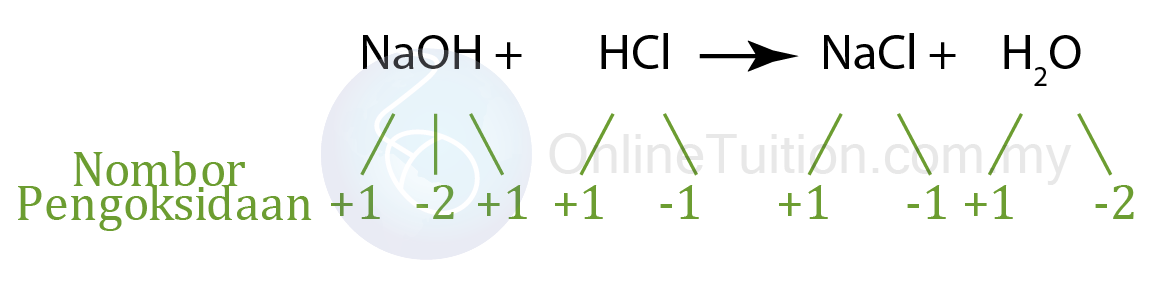 Tiada perubahan nombor pengoksidan dalam Na, O, H dan Cl.
Tiada perubahan nombor pengoksidan dalam Na, O, H dan Cl.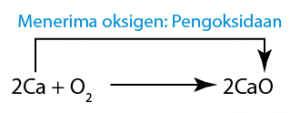 (Magnesium dioksidakan kepada magnesium oksida.)
(Magnesium dioksidakan kepada magnesium oksida.)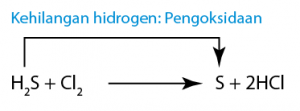 (Hidrogen sulfida menghilang hidrogen dan dioksidakan kepada sulfur.)
(Hidrogen sulfida menghilang hidrogen dan dioksidakan kepada sulfur.)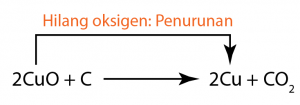 (Kuprum(II) oksida menghilang oksigen dan diturunkan kepada logam kuprum.)
(Kuprum(II) oksida menghilang oksigen dan diturunkan kepada logam kuprum.) (Klorin menerima hidrogen dan diturunkan kepada hidrogen klorida).
(Klorin menerima hidrogen dan diturunkan kepada hidrogen klorida).