admin
admin
Kedudukan karbon dalam siri keraktifan logam
- Kedudukan karbon dalam siri kereaktifan logam boleh ditentukan berdasarkan:
- Keupayaan logam untuk mengambil oksigen dari oksida karbon, iaitu karbon dioksida.
- Keupayaan karbon untuk mengambil oksigen daripada oksida logam.
Eksperimen 1
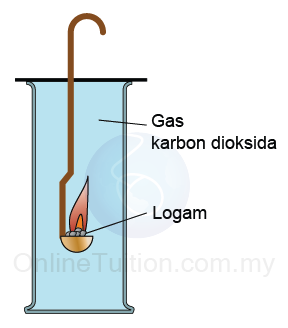
- Jika logam boleh mengambil oksigen daripada karbon dioksida, maka logam itu lebih reaktif daripada karbon.
Logam + karbon dioksida → logam oksida + karbon - Sebaliknya, jika logam tidak dapat mengambil oksigen daripada karbon dioksida, maka logam kurang reaktif daripada karbon.
Contoh
2Mg (s) + CO2(g) → 2MgO (s) + C (s)
Kesimpulan: Magnesium lebih reaktif daripada karbon kerana magnesium berupaya menyesarkan karbon daripada karbon dioksida.
Eksperimen 2
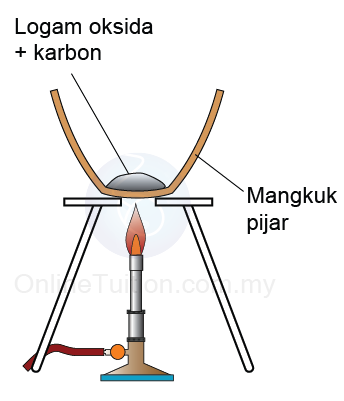
- Sekiranya karbon boleh mengambil oksigen daripada oksida logam, maka karbon lebih reaktif daripada logam.
Karbon + logam oksida → logam + karbon dioksida - Sebaliknya, jika karbon tidak dapat mengambil oksigen daripada satu logam oksida, maka karbon kurang reaktif daripada logam itu.
Contoh
Kesimpulan: Kuprum kurang reaktif daripada karbon kerana ia boleh disesarkan oleh karbon daripada oksidanya.
Carta di bawah menunjukkan kedudukan karbon dalam siri kereaktifan.

Pantulan Gelombang Bunyi
Pantulan Gelombang Bunyi
Eksperimen
Keputusan
Sudut tuju, i sama dengan sudut pantulan, r.
Kesimpulan:
- Gelombang bunyi mematuhi hukum-hukum pantulan, iaitu sudut tuju sama dengan sudut pantulan.
Soal dan Jawab
Mengapa papan lapis keras digunakan?
Permukaan yang keras adalah pemantul bunyi yang baik. Papan lapis keras digunakan supaya tenaga yang hilang semasa pantulan adalah minimum..
Soal dan Jawab
Mengapa jam randik mekanikal digunakan sebagai sumber suara?
Kerana bunyinya tidak terlalu kuat sehingga ia boleh didengar terus (tanpa pantulan) oleh pemerhati.
Soal dan Jawab
Mengapa tiub kadbod digunakan?
Tiub kadbod digunakan untuk membantu menentukan arah gelombang bunyi tuju dan gelombang bunyi yang dipantulkan..
Soal dan Jawab
Mengapa kayu lembut diletak di antara jam randik dan pemerhati?
Kayu lembut dapat menyerap sebarang bunyi dari jam randik dan menghalangnya daripada mencapai pemerhati..
Siri Kereaktifan
- Apabila logam bertindak balas dengan oksigen untuk membentuk oksida logam, tindak balas redoks berlaku.Metal + Oxygen → Metal oxide
- Dalam tindak balas ini,
- logam dioksidakan membentuk ion logam. Nombor pengoksidaan logam bertambah.
- oksigen diturunkan kepada ion oksida. Nombor pengoksidaan oksigen berkurangan dari 0 ke -2.
- logam berfungsi sebagai agen penurunan manakala oksigen bertindak sebagai agen pengoksidaan.
- logam yang berbeza terbakar dalam oksigen dengan kadar yang berlainan bergantung kepada kereaktifan mereka yang berlainan.
- Lebih reaktif satu logam bertindak dengan oksigen, lebih cepat pembakaran berlaku dan lebih cerah cahaya yang dihasilkan.
- Susunan logam mengikut kecenderungan tindak balas dengan oksigen untuk membentuk oksida logam dikenali sebagai siri reaktiviti logam.
- Rajah di bawah menunjukkan eksperimen yang dilakukan untuk membina siri kereaktifan logam. Jadual di bawah menunjukkan hasil eksperimen.
| Logam | Pemerhatian |
| Magnesium | Terbakar dengan cepat dengan nyalaan putih berkilau yang terang. Serbuk putih terbentuk. |
| Zink | Nyalaan terang merebar perlahan-lahan. Serbuk yang dihasilkan adalah kuning apabila panas, putih apabila ia sejuk. |
| Ferum | Baraan menyebar. Serbuk perang kemerahan terbentuk. |
| Plumbum | Baraan menyebar secara perlahan-lahan. Serbuk yang dihasilkan adalah perang apabila panas, kuning apabila sejuk. |
| Kuprum | Serbuk membara dengan sangat pelahan. Serbuk hitam terbentuk. |

- Oksigen yang digunakan dalam pembakaran logam dihasilkan dengan memanaskan pepejal kalium permanganat(VII).
2 KMnO4 → K2MnO4 + MnO2(p) + O2
Ia juga boleh diperolehi daripada- Pemanasan campuran kalium klorat(V) dan mangan(IV) oksida (sebagai mangkin)
2KClO3 (p) → 2KCl (p) + 3O2(g) - pemanasan kalium nitrat
2KNO3 (p) → 2KNO2 (p) + O2(g) - penguraian hidrogen peroksida dengan mangan(IV) oksida sebagai mangkin
2H2O2 (ce) → 2H2O2 + O2
- Pemanasan campuran kalium klorat(V) dan mangan(IV) oksida (sebagai mangkin)
Pantulan Gelombang Cahaya
Pantulan Gelombang Cahaya
- Pantulan cahaya membolehkan kita melihat objek. Objek yang tidak memancarkan cahaya tidak kelihatan dalam gelap. Objek hanya dapat dilihat jika cahaya mengena ke atasnya terpantul ke mata kita
Eksperimen
- Eksperimen pantulan gelombang cahaya (rajah di atas) menunjukkan bahawa pantulan gelombang cahaya mematuhi hukum pantulan.
Aplikasi Pantulan Cahaya
Kaedah Pencegahan Pengaratan
Penggunaan Logam yang Kurang Elektropositif
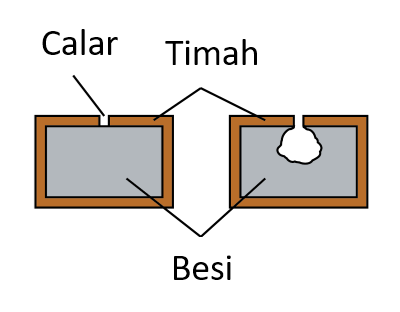
- Penyaduran besi dengan satu lapisan nipis logam yang kurang elektropositif seperti timah, perak atau tembaga akan menghalang besi di bawahnya daripada bertindak balas dengan air dan udara, dan seterusnya mencegah besi daripada berkarat.
- Bagaimanapun, besi yang berkarat akan berlaku lebih cepat jika lapisan pelindung tercalar. Ini kerana besi lebih elektropositif berbanding dengan timah, perak atau tembaga. Penyaduran besi dengan timah banyak digunakan dalam pembuatan makanan dalam tin.
Penggunaan Logam yang Lebih Elektropositif
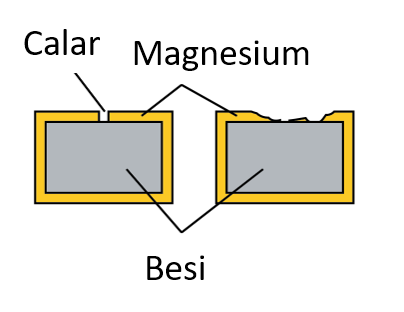
- Logam yang lebih elektropositif digunakan sebagai logam korban untuk menghalang kakisan pada logam yang kurang elektropositif. Logam yang lebih elektroforik terkakis dan bertindak sebagai anod.
- Logam yang kurang elektropositif bertindak sebagai katod dan dilindungi dari terkakis. Kaedah ini dikenali sebagai perlindungan katod atau perlindungan elektrokimia.
Tutup Dengan Cat, Minyak atau Gris
- Lapisan cat, minyak/gris, atau plastik digunakan untuk menghalang permukaan besi daripada bersentuhan dengan udara dan air di atmosfera. Oleh itu, pengaratan boleh dielakkan.
- Sebagai contoh,
- Perlindungan oleh lapisan cat biasanya digunakan untuk objek besi dan keluli seperti kereta, kapal, jambatan dan lain-lain yang tidak mengalami geseran semasa penggunaan.
- Perlindungan oleh lapisan minyak/gris digunakan untuk sebahagian jentera yang bergerak.
- Perlindungan oleh plastik digunakan untuk barangan harian di rumah seperti penggantung pakaian dan pagar.
- Pengaloian besi juga boleh mencegah karat. Sebagai contoh, pengaloian besi dengan kromium dan nikel membentuk keluli tahan karat. Lapisan kromium oksida yang keras, kuat dan sukar untuk retak pada permukaan aloi besi menghalang besi daripada berkarat.
Pantulan
Pantulan
- Pantulan berlaku apabila gelombang tuju dikenakan ke atas satu pemantul kemudian dipantulkan balik.
- Arah perambatan gelombang berubah ketika dipantulkan.
- Panjang gelombang, frekuensi dan kelajuan gelombang tidak berubah.
- Amplitud gelombang mungkin berubah atau tidak bergantung kepada bahan pemantul dan bentuk muka gelombang.
Pantulan Gelombang Lurus dan Bulat
- Pantulan gelombang mematuhi hukum-hukum pantulan, iaitu
- Sudut tuju sama dengan sudut pantulan
- Gelombang tuju, gelombang terpantul dan normal terletak pada satah yang sama.
- Bagi pantulan gelombang membulat, jarak imej dari pemantul adalah sama dengan jarak sumber gelombang dari pemantul. (Rujuk rajah di bawah)
 |
| (Pantulan gelombang satah) |
 |
| (Pantulan gelombang membulat) |
Kakisan Sebagai Tindak Balas Redoks
- Kakisan logam = logam kehilangan elektronnya untuk membentuk ion positif.
Contoh
Kakisan besi (forum)Fe → Fe2+ + 2eKakisan Magnesium
Mg → Mg2+ + 2e - Semakin tinggi kedudukan logam dalam siri elektrokimia, semakin elektropositif (reaktif) logam itu.
- Logam mempunyai kecenderungan yang lebih besar untuk melepaskan elektron untuk membentuk ion logam, iaitu logam lebih mudah terkakis.
- Sebagai contoh, logam magnesium logam lebih mudah terkakis berbanding dengan kuprum kerana magnesium lebih elektroposif daripada tembaga.
- Kakisan logam adalah tindak balas redoks kerana logam kehilangan elektron kepada oksigen dan air (yang bertindak sebagai agen pengoksidaan untuk menerima elektron).
- Kakisan besi juga dipanggil berkarat.Fe (s) → Fe2+ (aq) + 2e
- Pengaratan besi hanya boleh berlaku jika kedua-dua oksigen dan air hadir.
Pengaratan Besi
- Semasa pengaratan besi, besi bertindak sebagai agen penurunan manakala gas oksigen sebagai agen pengoksidaan.
- Proses pengaratan besi boleh dijelaskan dengan menggunakan rajah di bawah.
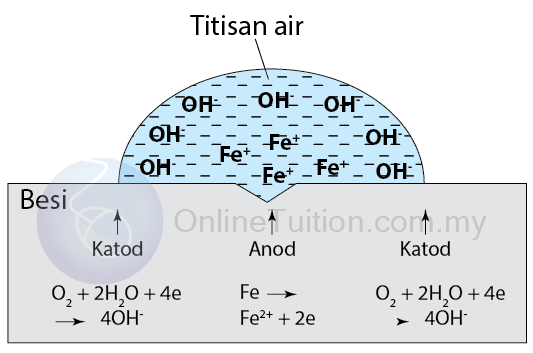
- Apabila permukaan besi terdedah kepada titisan air, pusat titisan air mengalami proses pengoksidaan dan bertindak sebagai anod.
- Pinggir titisan air mengalami proses penurunan dan bertindakan sebagai katod. (Pinggir titisan air bertindak sebagai katod kerana kepekatan oksigen yang terlarut lebih tinggi di pinggir titisan air daripada di bahagian tengah.)
- Di anod, besi logam mengalami pengoksidaan dan membentuk ion besi (II) dengan kehilangan elektron.Fe → Fe2+ + 2e
- Elektron yang bebas mengalir ke anod melalui logam besi ke kawasan katod di mana oksigen melarut dalam air dan menerima elektron untuk membentuk ion hidroksida.O2 + 2H2O + 4e → 4OH–
- Ion besi (II) kemudiannya bergabung dengan ion hidroksida untuk membentuk ferum(II) hidroksida.Fe2+ + OH- → Fe(OH)2
- Ferum(II) hidroksida kemudian dioksidakan oleh oksigen untuk membentuk ferum(III) hidroksida.4Fe(OH)2 + 2H2O + O2 → 4Fe(OH)3
- Ferum(III) hidroksida kemudian diuraikan untuk membentuk ferum(III) oksida terhidrat, Fe2O3 • xH2O oleh oksigen di udara.4Fe(OH)3 → Fe2O3•xH2O
- Ferum(III) oksida terhidrat berwarna perang dan dikenali sebagai karat.
- Persamaan keseluruhan untuk pengaratan besi adalah
Tindak Balas Redoks Melibatkan Pemindahan Elektron Pada Suatu Jarak
- Tindak balas redoks berlaku apabila larutan suatu agen pengoksidaan bercampur dengan larutan agen penurunan.
- Sekiranya larutan agen pengoksidaan dan larutan agen penurunan dipisahkan oleh elektrolit dalam tiub-U, tindak balas redoks masih akan berlaku tetapi pemindahan elektron akan berlaku melalui wayar penghubung.
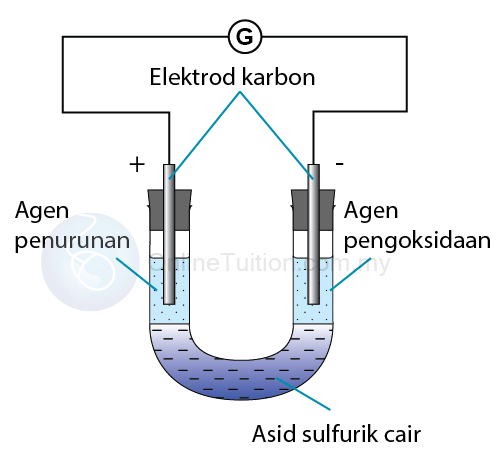
- Agen penurunan itu mengalami pengoksidaan dengan kehilangan elektron. Oleh itu, elektrod karbon yang direndam dalam larutan agen penurunan menjadi terminal sel negatif.
- Aliran elektron melalui wayar penghubung ke elektrod karbon yang direndam dalam larutan agen pengoksidaan. Elektrod karbon bertindak sebagai terminal sel positif.
- Agen pengoksida mengalami penurunan dengan penerimaan elektron.
Panduan untuk Menyelesaikan Masalah Berkaitan Pemindahan Elektron Pada Satu Jarak
- Pengoksidaan selalu berlaku di anod.
- Penurunan sentiasa berlaku di katod.
- Anod adalah terminal negatif.
- Katod adalah terminal positif.
Tindak Balas Di Antara Kalium Dikromat(VI) dan Kalium Iodida
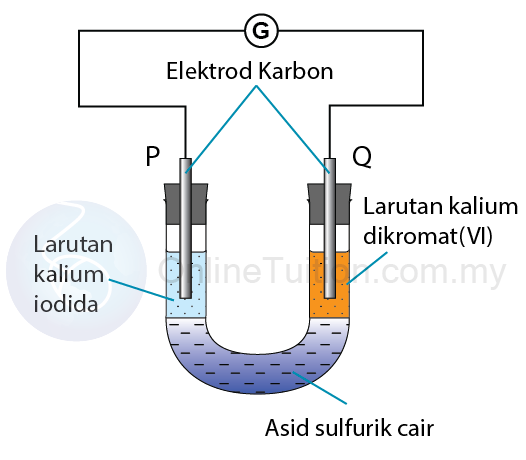
Langkah 1: Mengenalpasti agen pengoksidaan dan agen penurunan
Agen pengoksidaan: Kalium dikromat (VI)
Agen penurunan: Kalium iodida
Langkah 2: Menentukan proses pengoksidaan dan penurunan dan meramalkan pemerhatian
Pengoksidaan
Agen pengosidaan (kalium iodida) mengalami pengoksidaan
Pemerhatian: Larutan tanpa warna menjadi kuning/jingga.
Nota: Kalium iodida adalah larutan tidak berwarna manakala iodin berwarna kuning atau jingga apabila larut dalam air.
Penurunan
Agen pengoksida mengalami penurunan
Pemerhatian: Warna jingga larutan bertukar menjadi hijau.
Nota: Ion dikromat (VI) berwarna jingga manakala ion kromium (III) berwarna hijau
Langkah 3: Mengenal pasti anod dan katod
Elektrod P: Anod
Elektrod Q: Katod
Nota: Pengoksidaan berlaku di anod manakala penurunan terjadi di katod.
Langkah 4: Tentukan terminal positif dan negatif
Terminal positif: Elektrod Q
Terminal negatif: Elektrod P
Nota: Anod adalah terminal negatif manakala katod adalah terminal positif.
Langkah 5: Tentukan arah pengaliran elektron.
Dari elektrod P ke elektrod Q.
Nota: Aliran elektron dari terminal negatif ke terminal positif melalui dawai.
Tindak Balas Di Antara Ferum(II) Sulfat dan Air Bromin
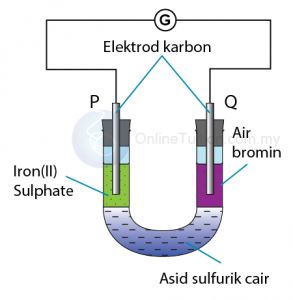
Langkah 1: Mengenalpasti agen pengoksidaan dan agen penurunan
Agen pengoksidaan: Air bromin
Agen penurunan: Ferum(II) sulfat
Langkah 2: Menentukan proses pengoksidaan dan penurunan dan meramalkan pemerhatian
Pengoksidaan
Agen penurunan mengalami pengoksidaan
Pemerhatian: Warna hijau larutan ferum(II) sulfat bertukar menjadi perang.
Nota: Ion ferum(II) berwarna hijau manakala ion ferum(III) berwarna perang
Penurunan
Agen pengoksidaan mengalami penurunan
Pemerhatian: Warna kuning/jingga air bromin menjadi tidak berwarna.
Nota: Bromin berwarna kuning/jingga dalam air manakala bromida tidak berwarna.
Langkah 3: Mengenal pasti anod dan katod
Elektrod P: Anod
Elektrod Q: Katod
Nota: Pengoksidaan berlaku di anod manakala penurunan terjadi di katod.
Langkah 4: Tentukan terminal positif dan negatif
Terminal positif: Elektrod Q
Terminal negatif: Elektrod P
Nota: Anod adalah terminal negatif manakala katod adalah terminal positif.
Langkah 5: Tentukan arah pengaliran elektron.
Dari elektrod P ke elektrod Q.
Nota: Aliran elektron dari terminal negatif ke terminal positif melalui dawai.
Fenomena Gelombang
Tangki Riak
Soal and Jawab
Apakah fungsi motor penggetar?
Fungsi motor adalah untuk menghasilkan gerakan berulang seterusnya menghasilkan gelombang.
Soal and Jawab
Apakah fungsi pencelup?
- Untuk menghasilkan gelombang dengan bentuk yang berbeza
- Gelombang satah boleh dihasilkan oleh jalur kayu lurus.
- Gelombang membulat boleh dihasilkan oleh pencelup sfera
Soal and Jawab
Apakah fungsi span?
Fungsi span adalah untuk mencegah pantulan gelombang.
Soal and Jawab
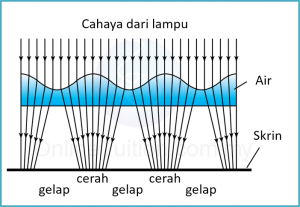
Terangkan bagaimana jalur gelap dan terang terbentuk di skrin.
- Jalur gelap dan terang terbentuk di skrin disebabkan oleh pembiasan cahaya.
- Seperti yang ditunjukkan dalam gambar di bawah, ketika cahaya dari lampu mencapai kawasan di sekitar puncak gelombang, cahaya akan ditumpukan dan membentuk jalur terang di skrin putih.
- Sebaliknya, ketika cahaya dari lampu mencapai kawasan di sekitar palung gelombang, cahaya akan dicapah dan membentuk jalur gelap di layar.
Fenomena Gelombang
- Terdapat 4 fenomena gelombang:
- pantulan
- pembiasan
- belausan
- interferes
- Belauan dan interferens adalah fenomena yang unik, iaitu hanya gelombang sahaja yang menunjukkan fenomena-fenomena ini.