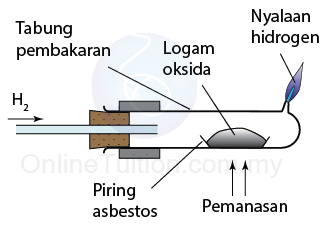
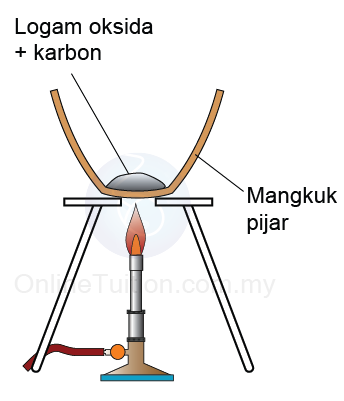
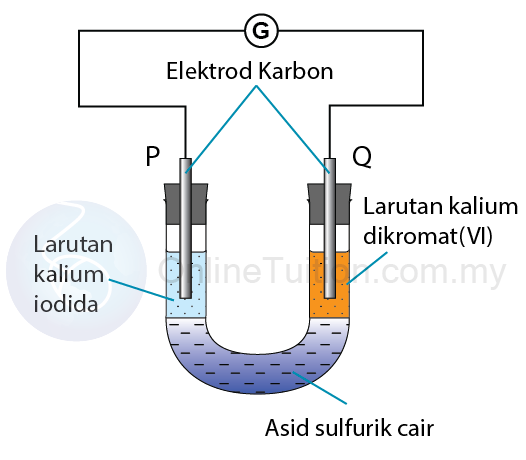
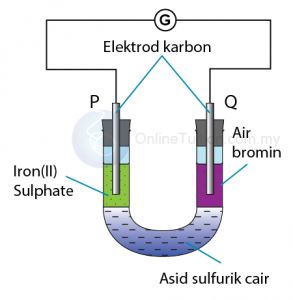
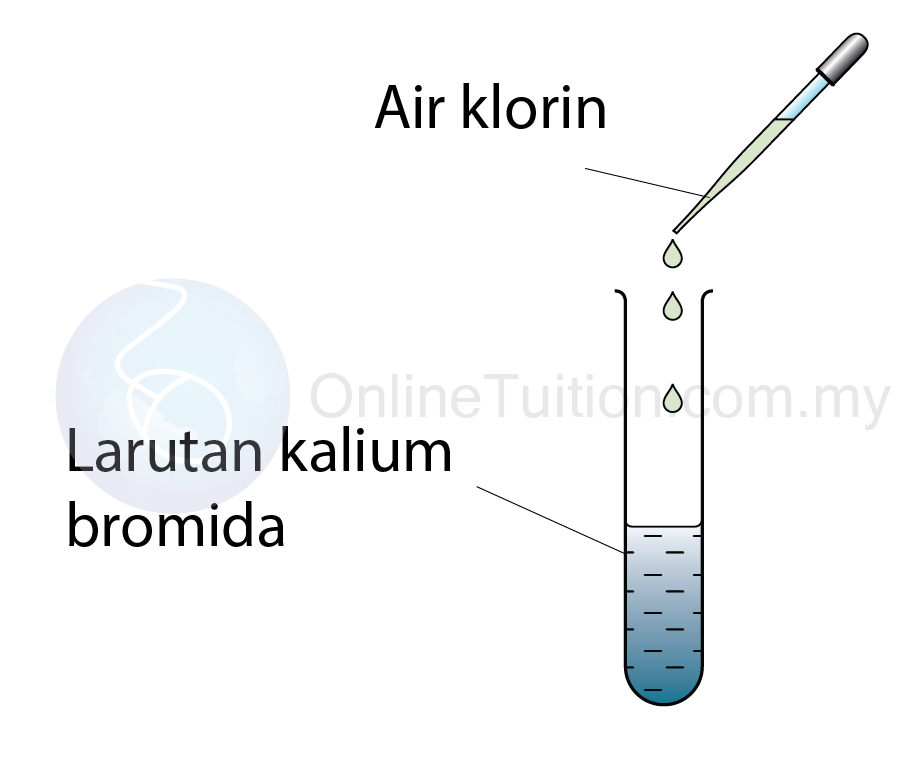
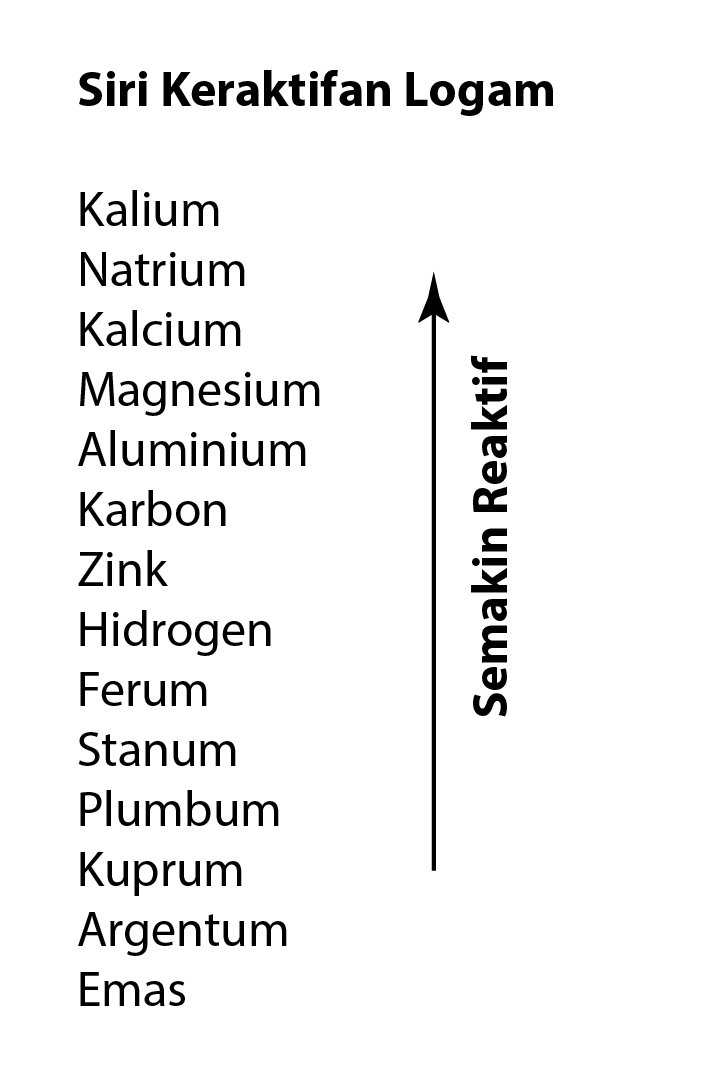
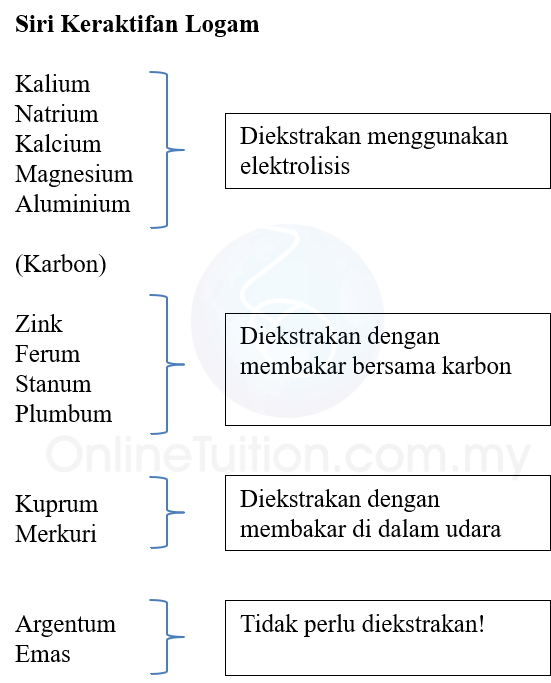
Kegunaan Siri Kreaktifan Logam dalam Pengekstrakan Logam
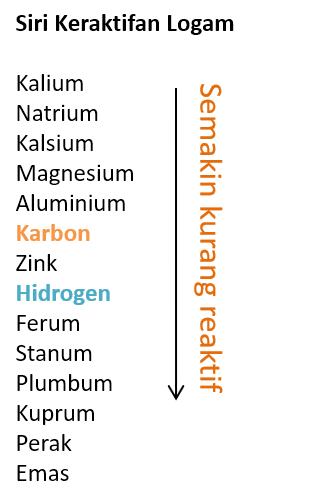
- Kaedah yang digunakan dalam pengekstrakan logam dari bijihnya bergantung kepada kedudukan logam dalam siri reaktiviti logam.
- Logam yang terletak lebih rendah daripada karbon dalam siri kereaktifan logam boleh diekstrak menggunakan penurunan oksida logam oleh karbon dalam relau bagas.
- Logam yang terletak lebih tinggi daripada karbon dalam siri keraktifan logam diekstrak dengan proses elektrolisis leburan sebatian logam.
- Carta di bawah memberi kaedah pengekstrakan logam tertentu dengan merujuk kepada siri kereaktifan.
Pengekstrakan Besi
- Besi diekstrak daripada bijihnya, iaitu hematit (Fe2O3) dan magnetit (Fe3O4) melalui penurunan oleh karbon dalam bentuk kok dalam relau bagas.
- Campuran bijih besi, karbon, dan batu kapur dimasukkan ke dalam relau bagas melalui bahagian atas relau.
- Udara panas kemudian dialirkan di bahagian bawah relau
- Batu kapur (kalsium karbonat) diuraikan oleh udara panas kepada kalsium oksida dan gas karbon dioksida.CaCO3 (s) → CaO (s) + CO2(g)
- Karbon juga terbakar dalam udara panas untuk menghasilkan gas karbon dioksidaC (s) + O2 (g) → CO2 (g)
- Karbon dioksida yang dihasilkan bertindak balas dengan karbon yang kelebihan untuk menghasilkan gas karbon monoksida yang merupakan sejenis agen penurunan.CO2 + C → 2CO
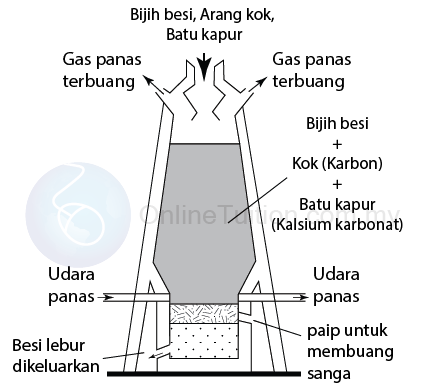
- Karbon dan karbon monoksida kemudian menurunkan bijih besi ke besi lebur yang mengalir ke bahagian bawah relau.
2Fe2O3(s) + 3C(s) → 4Fe(s) + 3CO2(g)
Fe2O3(s) + 3CO(g) → 2Fe(s) + 3CO2(g)
Fe3O4 (s) + C(s) → 3Fe(s) + 2CO2(g)
Fe3O4 (s) + 4CO(g) → 3Fe(s) + 4CO2(g) - Dalam relau bagas, kalsium oksida yang dihasilkan daripada penguraian kalsium karbonat, bertindak balas dengan bahan asing seperti pasir (silikon dioksida) dalam bijih besi untuk membentuk sanga.CaO (s) + SiO2 (s) → CaSiO3 (s) (slag)
- Leburan sanga mengalir ke bahagian bawah relau dan terapung di atas lapisan besi lebur.
- Besi dan bendasing yang dileburkan kemudian dikeluarkan dari relau secara berasingan.
- Besi lebur disejukkan dalam acuan untuk membentuk besi tuangan, manakala kotoran digunakan untuk menjadikan dasar bagi jalan dan rumah.
Pengekstrakan Timah
- Stanum wujud sebagai stanum(IV) oksida, SnO2 dalam kasiterit, iaitu timah. Timah mengandungi banyak bendasing seperti pasir, tanah, karbon dan minyak.
- Mula-mula, bijih timah dipekatkan di mana bijih timah dihancurkan dan digoncang dalam air berminyak. Bendasing seperti pasir dan tanah disalut keluar manakala bijih timah melekat pada minyak dan terapung di permukaan air.
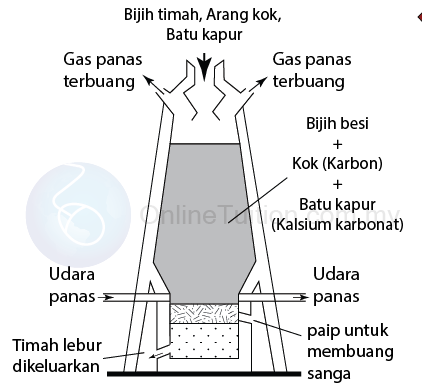
- Bijih timah kemudiannya dikutip dan dipanggang untuk membuang bendasing seperti karbon, sulfur dan minyak.
- Akhir sekali, bijih timah bercampur dengan karbon dalam bentuk arang dan dipanaskan dalam relau bagas pada suhu yang tinggi.
- Stanum(IV) oksida dalam bijih diturunkan kepada stanum (timah) oleh karbon sebagai agen penurunan dan karbon monoksida.
SnO2 (p) + 2C(p) → Sn (p) + 2CO (g)
SnO2 (p) + C(p) → Sn (p) + CO2 (g)
SnO2 (p) + 2CO(p) → Sn (p) + 2CO2 (g) - Stanum lebur yang terbentuk bentuk mengumpul di dasar relau kemudian disalurkan ke dalam acuan untuk membentuk jongkong timah.