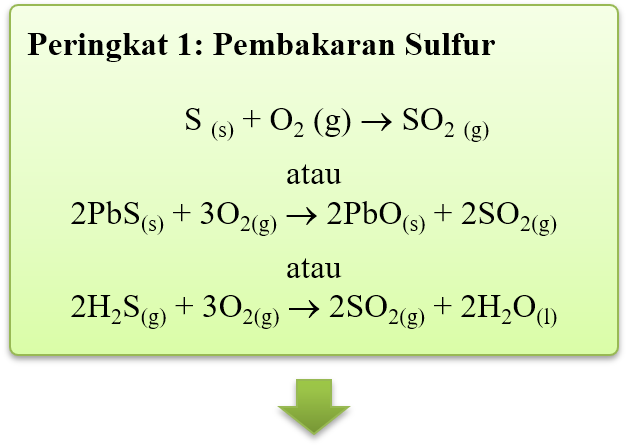
- Contoh-contoh aloi kuprum adalah
- Kupro-nickel
- Gangsa
- Loyang
- Kebanyakan aloi kuprum mempunyai permukaan berkilat
Kupro-nickel
Komponen: Cu 75%, Ni 25%
Kegunaan: Syiling
Gangsa
Komponen: Cu 90%, Sn 10%
Kegunaan: Barang hiasan, pingat, kunci, karya seni, periuk dan kuali
Loyang
Komponen: Cu 70%, Zn 30%