Penerangan oleh Teori Perlanggaran
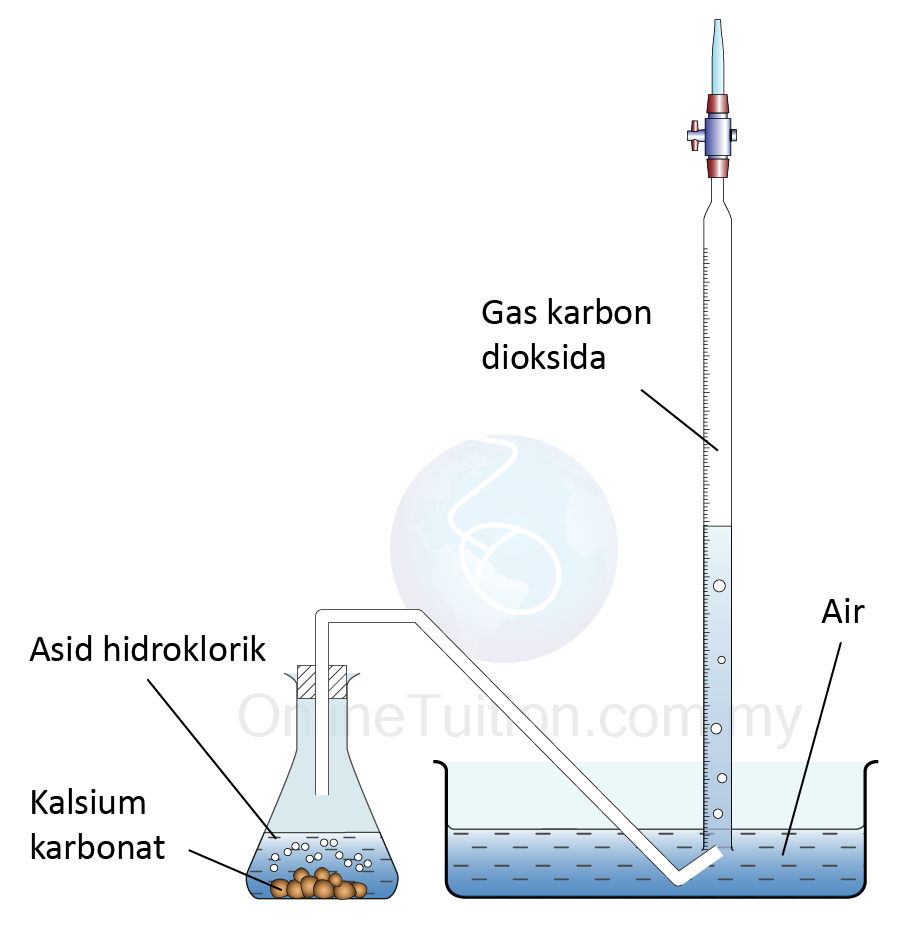
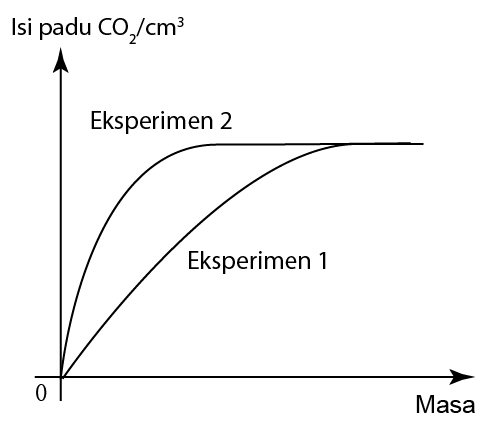
Jumlah Luas Permukaan Bahan Tindak Balas
- Apabila saiz bahan pepejal yang bertindak balas lebih kecil, jumlah kawasan permukaan yang terdedah menjadi lebih besar.
- Ini menyebabkan frekuensi perlanggaran antara bahan tindak balas meningkat.
- Akibatnya, frekuensi perlanggaran berkesan juga meningkat dan dengan demikian meningkatkan kadar tindak balas.
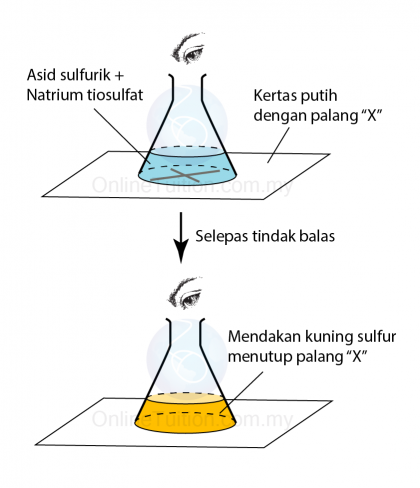
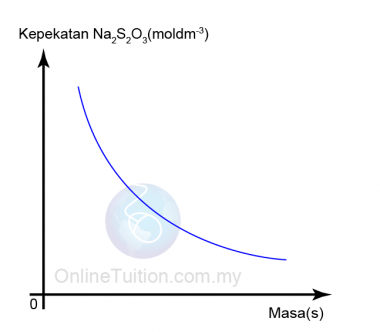
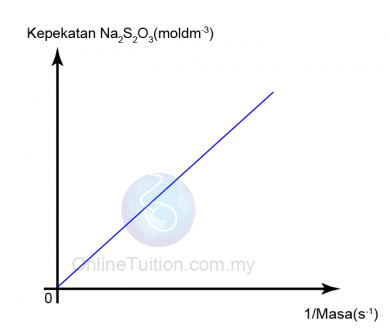
Kepekatan
- Larutan dengan kepekatan yang lebih tinggi mempunyai lebih banyak zarah per unit isi padu dalam larutan.
- Oleh itu, frekuensi perlanggaran antara bahan tindak balas meningkat.
- Akibatnya, frekuensi perlanggaran berkesan juga meningkat dan oleh itu kadar tindak balas meningkat.
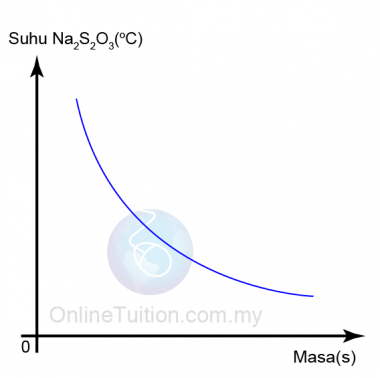
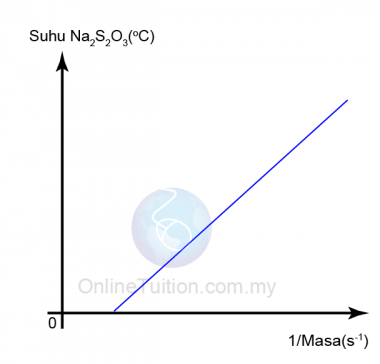
Suhu
- Apabila suhu tindak balas meningkat, zarah-zarah bahan tindak balas bergerak dengan lebih cepat.
- Ini menyebabkan frekuensi perlanggaran antara bahan tindak balas meningkat.
- Akibatnya, frekuensi perlanggaran berkesan juga meningkat dan dengan demikian meningkatkan kadar reaksi.
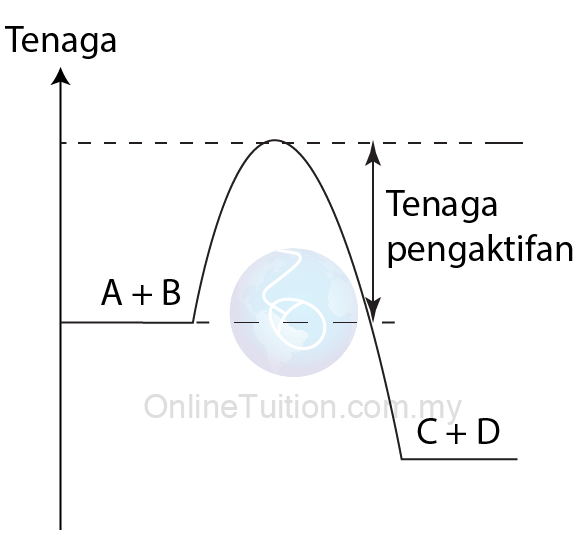
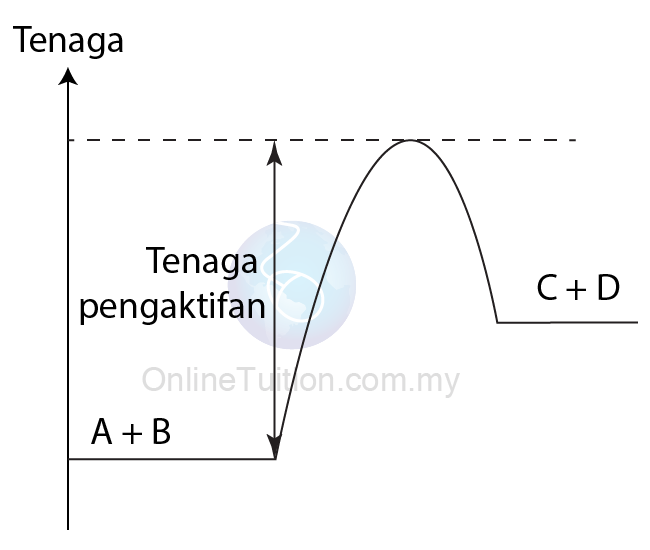
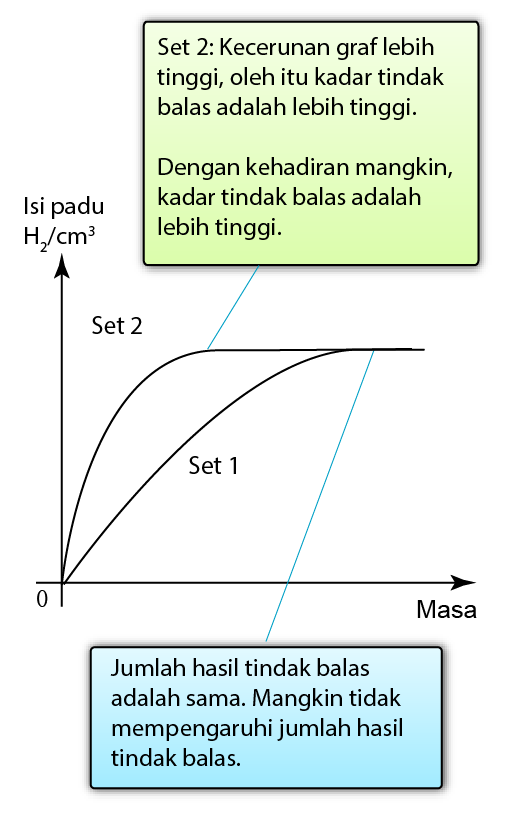
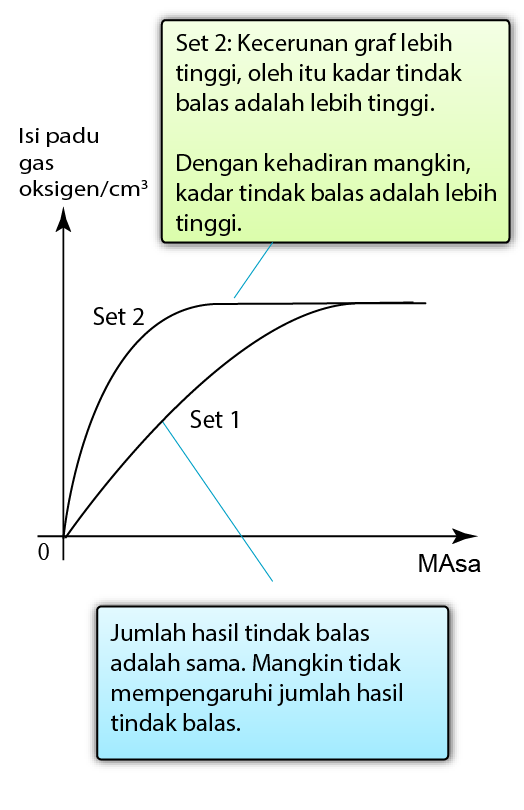
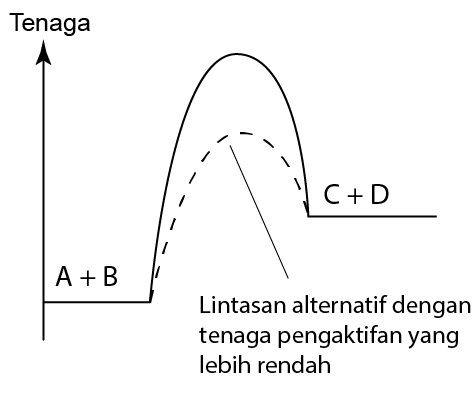
Kehadilan Mangkin
- Apabila mangkin positif digunakan dalam tindak balas, mangkin itu menyediakan lintasan alternatif dengan tenaga pengaktifan yang lebih rendah untuk tindak balas.
- Akibatnya, frekuensi pelanggaran berkesan meningkat dan dengan demikian meningkatkan kadar tindak balas.
Tekanan Gas
- Bagi tindak balas yang melibatkan gas, apabila tekanan meningkat, zarah gas dimampatkan untuk mengisi ruang yang kecil. Ini menjadikan bilangan zarah gas per unit isipadu meningkat.
- Dengan ini, frekuensi perlanggaran antara reaktan meningkat.
- Akibatnya, frekuensi perlanggaran berkesan juga meningkat dan dengan demikian meningkatkan kadar reaksi.