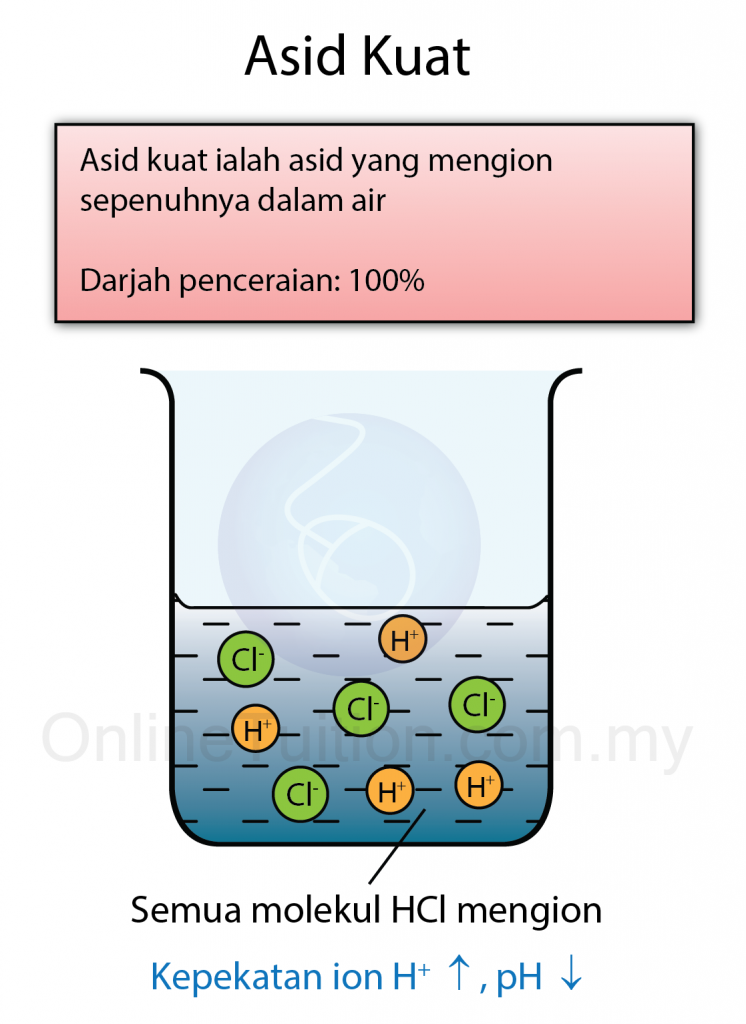
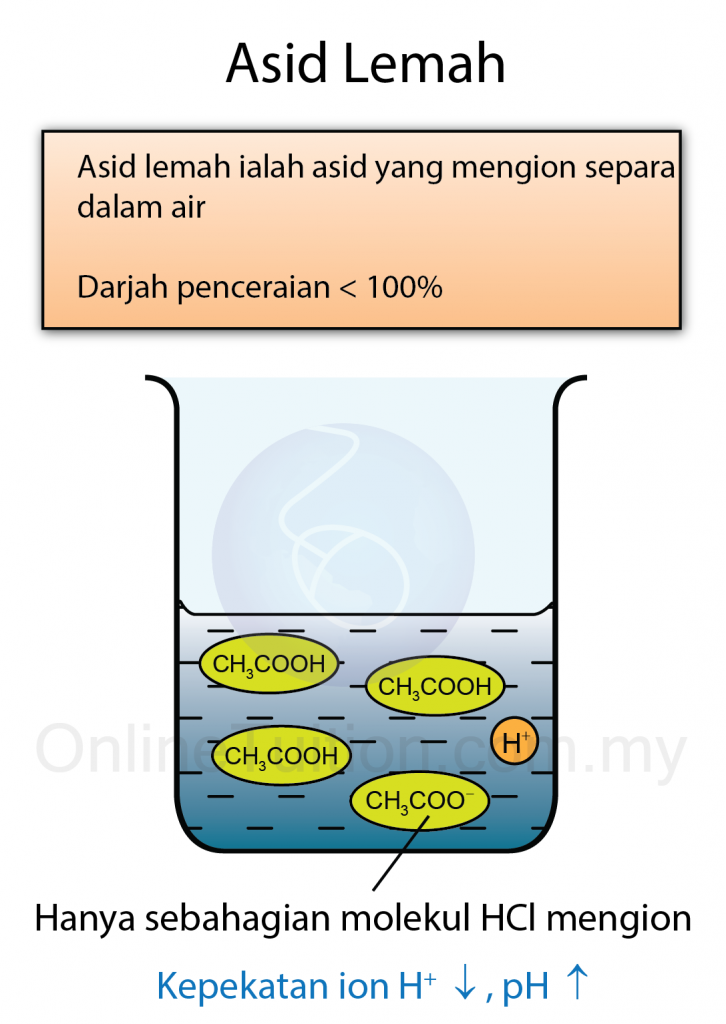
Kepekatan Asid dan Alkali
- Larutan terbentuk apabila zat terlarut dilarutkan dalam pelarut.
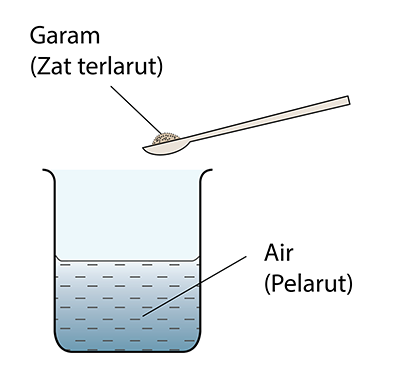
- Kepekatan ialah satu ukuran kuantiti zat terlarut dalam satu unit isi padu pelarut. Isi padu yang biasa digunakan ialah 1 dm3 atau 1 cm3.
- Dalam kimia, kuantiti zat terlarut boleh disukat dalam unit “ gram ” atau “ mol ”. Oleh itu, dua unit kepekatan larutan telah digunakan, iaitu g dm-3 dan mol dm-3.
Kepekatan Dalam Unit g/dm3
- Unit “ g dm-3” bermaksud “jisim zat terlarut dalam gram yang terdapat dalam satu dm3 larutan”. Misalnya:
- 3g natrium hidroksida terlarut dalam 1 dm3 air. Kepekatan larutan natrium hidroksida = 3g/dm3
- 3.5g kuprum (II) sulfat terlarut dalam 50cm3 air. Kepekatan larutan kuprum (II) sulfat = 0.07g/cm3 atau 70g/dm3.
( 1 dm = 10 cm, maka 1 dm3 = 1000 cm3 )
Contoh:
50g kuprum(II) sulfat kontang dilarut dalam air untuk menghasilkan 250cm3 larutan. Hitungkan kepekatan larutan terhasil dalam g dm-3.
Jawapan:
123
50g kuprum(II) sulfat kontang dilarut dalam air untuk menghasilkan 250cm3 larutan. Hitungkan kepekatan larutan terhasil dalam g dm-3.
Jawapan:
123
Contoh:
28g kalium hidroksida dilarutkan dalam air untuk menyediakan 200cm-3 larutan. Berapakah kemolaran larutan kalium hidroksida yang terhsil?
[ Jisim atom relatif: H = 1; O = 16; K = 39 ]
Jawapan:
123
28g kalium hidroksida dilarutkan dalam air untuk menyediakan 200cm-3 larutan. Berapakah kemolaran larutan kalium hidroksida yang terhsil?
[ Jisim atom relatif: H = 1; O = 16; K = 39 ]
Jawapan:
123
Kepekatan Dalam Unit mol/dm3
- Unit “ mol dm-3 ” merupakan satu unit kepekatan larutan yang dikenali sebagai kemolaran.
- 2 mol ammonia terlarut dalam 1 dm3 air. Kepekatan larutan ammonia = 2 mol/dm3.
- takrifan bagi kemolaran ialah bilangan mol zat terlarut dalam 1 dm3 larutan.

Contoh:
0.3 mol natrium hidroksida dilarutkan dalam air untuk menghasilkan 200 cm3 larutan. Hitungkan kemolaran larutan itu.
Jawapan:
123
0.3 mol natrium hidroksida dilarutkan dalam air untuk menghasilkan 200 cm3 larutan. Hitungkan kemolaran larutan itu.
Jawapan:
123
Contoh:
28g kalium hidroksida dilarutkan dalam air untuk menyediakan 200cm-3 larutan. Berapakah kemolaran larutan kalium hidroksida yang terhasil?
[ Jisim atom relatif: H = 1; O = 16; K = 39 ]
Jawapan:
123
28g kalium hidroksida dilarutkan dalam air untuk menyediakan 200cm-3 larutan. Berapakah kemolaran larutan kalium hidroksida yang terhasil?
[ Jisim atom relatif: H = 1; O = 16; K = 39 ]
Jawapan:
123
Penukaran unit kepekatan
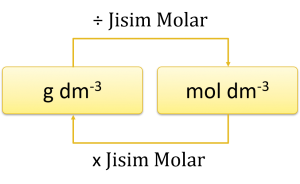
Contoh:
Satu larutan kalium klorida mempunyai kepekatan 14.9 g dm-3. Berapakah kemolaran larutan ini dalam mol dm-3?
[ Jisim atom relatif: Cl = 35.5; K = 39 ]
Jawapan:
123
Satu larutan kalium klorida mempunyai kepekatan 14.9 g dm-3. Berapakah kemolaran larutan ini dalam mol dm-3?
[ Jisim atom relatif: Cl = 35.5; K = 39 ]
Jawapan:
123
Contoh:
Satu larutan barium hidroksida mempunyai kepekatan 0.1 mol dm-3. Berapakah kepekatan larutan ini dalam g dm-3?
[ JAR: Ba = 137; O = 16; H = 1 ]
Jawapan:
123
Satu larutan barium hidroksida mempunyai kepekatan 0.1 mol dm-3. Berapakah kepekatan larutan ini dalam g dm-3?
[ JAR: Ba = 137; O = 16; H = 1 ]
Jawapan:
123
Contoh:
Kemolaran larutan X ialah 0.4 mol dm-3. Hitungkan jisim molekul relatif bagi asid X jika kepekatan lerutan ini ialah 14.6g dm-3.
Jawapan:
123
Kemolaran larutan X ialah 0.4 mol dm-3. Hitungkan jisim molekul relatif bagi asid X jika kepekatan lerutan ini ialah 14.6g dm-3.
Jawapan:
123