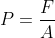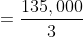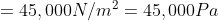Contoh 2:
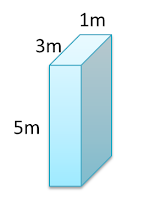
Satu bongkah kayu mempunyai panjang 3 m, lebar 5 m dan tebal 1 m thick diletakkan di atas satu meja. Jika ketumpatan kayu ialah 900 kgm-3, cari
- tekanan paling rendah
- tekanan paling tinggi
yang boleh dikenakan ke atas meja oleh bongkah kayu itu
Jawapan:
a.
Langkah pertama: Mencari berat bongkah
Isi padu bongkah = 3 x 5 x 1 = 15m³.
Jisim = Ketumpatan x Isi padu
Jisim bongkah, m = (900)(15)= 13500 kg
Berat bongkah = mg = 13500 x 10 = 135,000N
Langkah ke-2: Menetukan luas permukaan
Tekanan dikenakan berkadar songsang dengan luas permukaan. Semakin besar permukaan bertindak, semakin kecil tekanan.
Luas permukaan terbesar muka bongkah, A = 5 x 3 = 15m²
Langkah ke-3: Mencari tekanan
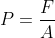
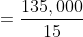
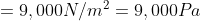
b.
Tekanan paling tinggi apabila luas permukaan bertindak adalah paling kecil (seperti dalam rajah di bawah)
Luas permukaan paling kecil bagi satu muka bongkah = 1 x 3 = 3m²
Tekanan paling tinggi,