Pembakaran
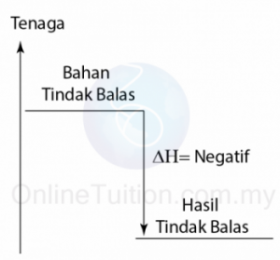
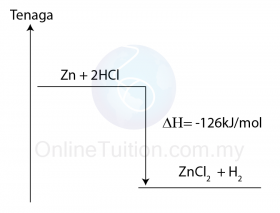
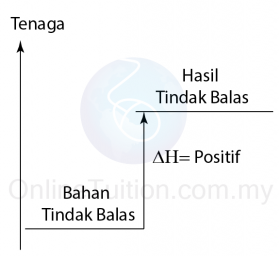
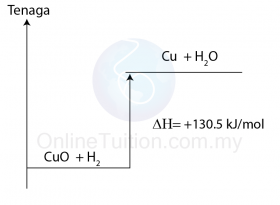
- Pembakaran ialah tindak balas di mana satu bahan membakar sepenuhnya di dalam oksigen berlebihan.
- Contohnya, pembakaran metana dalam oksigen berlebihan menghasilkan karbon dioksida dan air.
CH4 + 2O2 → CO2 + 2H2O - Semua pembakaran bahan api adalah tindak balas eksotermik.
Haba Pembakaran
Haba Pembakaran satu bahan ialah tenaga haba yang dibebaskan apabila 1 mol bahan dibakar sepenuhnya dalam oksigen berlebihan dalam keadaan piawai.
Menentukan Haba Pembakaran
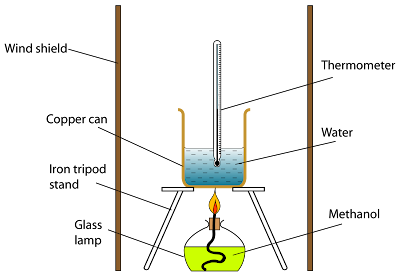
Rajah di bawah menunjukkan kaedah mudah untuk mendapatkan nilai anggaran bagi haba pembakaran satu bahan api.
- Satu lampu dengan bahan api dinyalakan dan tenaga haba yang dikeluarkan digunakan untuk memanaskan satu isi padu air yang tetap.
- Jisim bahan bakar ditimbang dan kenaikan suhu maksimum dicatat.
- Haba pembakaran dapat dikira dengan menggunakan formula
Kita membuat anggapan bahawa semua tenaga haba yang dibebaskan dari pembakaran bahan bakar diserap oleh air.
Langkah Berjaga-Jaga
- Gunakan pelindung angin untuk menyekat aliran udara. Ini dapat mengurangkan kehilangan haba ke sekitarnya.
- Jangan mengguna kasa dawai dalam pemanasan untuk mengurangkan kehilangan haba.
- Bekas kuprum digunakan kerana kuprum ialah konduktor haba yang baik,
- Api mesti diletakkan berhampiran dengan bekas,
- Air selalu dikacau dengan termometer.
- Peningkatan suhu air dihadkan di bawah 30 ° C untuk mengelakkan pemanasan berlebihan dan kehilangan tenaga ke sekitarnya,
- Bahan bakar ditimbang dengan kerap untuk mengelakkan kondensasi.