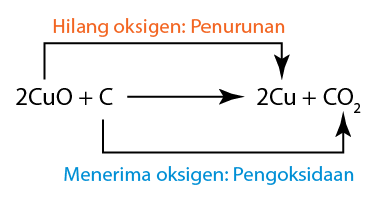
Tindak Balas Redoks Yang Dikaji Dalam SPM
- Tindak balas antara logam panas dan oksigen atau halogen
- Tindak balas ferum(II) kepada ion ferum(III) dan sebaliknya.
- Penyesaran logam daripada larutan garamnya.
- Penyesaran halogen daripada larutan halidanya
- Tindak balas antara satu logam dengan oksida logam lain
- Pemindahan elektron antara dua larutan pada satu jarak
- Tindak balas dalam elektrokimia (elektrolisis dan sel kimia)
- Kakisan logam dan pengaratan besi
Agen Pengoksidaan dan Agen Penurunan
- Dalam tindak balas redoks, sebatian yang diturunkan ialah agen pengoksida. Agen pengoksida ialah bahan yang mengoksida bahan lain.
- Sebaliknya, sebatian yang dioksidakan ialah agen penurunan. Agen penurunan menurunkan sesuatu bahan yang lain.
Contoh: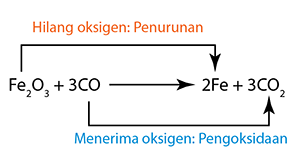
- Dalam tindak balas ini, ferum(III) oksida diturunkan. Oleh itu ia adalah agen pengoksida. Ia telah mengoksidakan karbon monoksida kepada karbon dioksida.
- Karbon monoksida telah dioksidakan. Oleh itu ia berfungsi sebagai agen penurunan. Ia telah menurunkan ferum(III) oksida kepada logam besi.
Agen Pengoksidaan Yang Biasa Digunakan
Kalium Permanganat (VII) Berasid
MnO4– + 8H+ + 5e → Mn2+ + 4H2O
Pemerhatian:
Warna ungu kalium manganat(VII) berasid menjadi tidak berwarna.
Kalium Dikromate (VI) Berasid
Cr2O72- + 14H+ + 6e → 2Cr3+ + 7H2O
Pemerhatian:
Warna jingga kalium dikromat (VI) berasid berubah menjadi hijau.
Hidrogen Peroksida
H2O2 + 2H+ + 2e → 2H2O
Asid Nitrik Pekat
NO3– + 4H+ + 3e → NO + 2H2O
Agen Penurunan Yang Biasa Digunakan
Sulfur Dioksida
SO2 + 2H2O → SO42- + 4H+ + 2e
Hidrogen Sulfida
H2S → 2H+ + S + 2e
Natrium Sulfit Akueous
SO32- + H2O → SO42- + 2H+ + 2e
Stanum(II) Klorida Akueous
Sn2+ → Sn4+ + 2e