- Dari definisi beza keupayaan, kerja elektrik yang dilakukan diberikan oleh persamaan W = QV
Di mana
W = kerja, Q = cas, V = beza keupayaan - Oleh kerana kerja yang dilakukan mestilah sama dengan tenaga melakukan kerja, oleh itu kita juga boleh mengatakan bahawa tenaga elektrik (E) juga diberikan oleh formula E = QV
 admin
admin
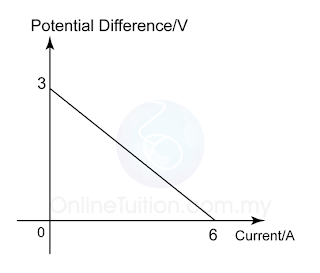
Graf Linear
by admin
Daripada persamaan,
E = V + Ir
Maka
V = -rI + E
Pakti-Y = Beza keupayaan (V)
Paksi-X = Arus (I)
Kecerunan graf, m = – rintangan dalam (r)
Pintasan-Y pada graf, c = d.g.e.
Persamaan Serentak
by admin
Contoh 1
Apabila satu perintang 1Ω disambungkan ke terminal sel, arus yang mengalir melaluinya ialah 8A. Apabila perintang itu digantikan oleh perintang lain dengan rintangan 4Ω, arus berubah menjadi 2⅔A. Cari
Apabila satu perintang 1Ω disambungkan ke terminal sel, arus yang mengalir melaluinya ialah 8A. Apabila perintang itu digantikan oleh perintang lain dengan rintangan 4Ω, arus berubah menjadi 2⅔A. Cari
- Rintangan dalam sel
- D.g.e. sel
Jawapan:
Eksperimen 1
R1 = 1Ω
I1 = 8A
E = IR+Ir
E = (8)(1)+(8)r
E−8r = 8 ——(1)
Eksperimen 2
R2 = 4Ω
I2 = 2⅔A
E=IR+Ir
E=(2⅔ )(4)+(2⅔ )r
3E−8r=32 ——(2)
Selesaikan persamaan serentak
E = 12V, r = 0.5Ω
Contoh 2
 Rajah di atas menunjukkan bahawa beza keupayaan terminal bateri ialah 1.2V apabila perintang 4 Ω disambungkan kepadanya. Beza keupayaan terminal menjadi 1.45V apabila perintang itu digantikan oleh satu perintang lain yang berintangan 29Ω. Cari
Rajah di atas menunjukkan bahawa beza keupayaan terminal bateri ialah 1.2V apabila perintang 4 Ω disambungkan kepadanya. Beza keupayaan terminal menjadi 1.45V apabila perintang itu digantikan oleh satu perintang lain yang berintangan 29Ω. Cari
 Rajah di atas menunjukkan bahawa beza keupayaan terminal bateri ialah 1.2V apabila perintang 4 Ω disambungkan kepadanya. Beza keupayaan terminal menjadi 1.45V apabila perintang itu digantikan oleh satu perintang lain yang berintangan 29Ω. Cari
Rajah di atas menunjukkan bahawa beza keupayaan terminal bateri ialah 1.2V apabila perintang 4 Ω disambungkan kepadanya. Beza keupayaan terminal menjadi 1.45V apabila perintang itu digantikan oleh satu perintang lain yang berintangan 29Ω. Cari- Rintangan dalam, r
- D.g.e. bateri.
Jawapan:
Eksperimen 1
V1 = 1.2V
R1 = 4Ω
I= V/R
I= 1.2/4 =0.3A
E=V+Ir
E=1.2+0.3r
E−0.3r=1.2 ——(1)
Eksperimen 2
V2 = 1.45V
R2 = 29
I= V/R
I= 1.45/29 =0.05A
E=V+Ir
E=1.45+0.05r
E−0.05r=1.45 ——(1)
Selesaikan persamaan serentak
E = 1.5V, r = 1Ω
Litar Terbuka/Litar Tertutup
by admin
Litar Terbuka
Dalam litar terbuka (semasa suis dimatikan), voltmeter menunjukkan bacaan d.g.e.
Litar Tertutup
Dalam litar tertutup (semasa suis dihidupkan), voltmeter menunjukkan bacaan beza keupayaan merentasi sel.
Dengan adanya rintangan dalam, beza keupayaan merentasi sel sentiasa lebih kecil daripada d.g.e.
Contoh 1:
Rajah di atas menunjukkan satu litar ringkas yang menyambungkan beberapa sel ke perintang. Voltmeter menunjukkan bacaan 5.0V semasa suis dimatikan dan 4.5V ketika suis dihidupkan. Berapakah d.g.e. dan rintangan dalam sel?
Jawapan:
Apabila suis dimatikan, bacaan voltmeter menunjukkan d.g.e. bateri. Oleh itu.
D.g.e. = 5.0V
Apabila suis dihidupkan, bacaan voltmeter menunjukkan beza keupayaan perintang. Oleh itu,
V = 4.5V
Arus yang mengalir melalui perintang,,
I= V/R
I = 4.5/9
I = 0.5A
E=V+Ir
(5.0)=(4.5)+(0.5)r
0.5r=5.0−4.5
0.5r = 0.5
r= 0.5/0.5 =1Ω
Contoh 2:
 |
| Diagram (a) |
 |
| Diagram (b) |
Satu sel disambungkan ke litar seperti ditunjukkan dalam rajah (a) Graf dalam rajah (b) menunjukkan perubahan bacaan voltmeter, V melawan masa, t. Sekiranya t adalah masa di mana suis ditutup, cari
(a) D.g.e. Sel
(b) rintangan dalam sel.
Jawapan:
(a) Sebelum suis dihidupkan, bacaan ammeter menunjukkan d.g.e. sel.
Daripada graf, d.g.e. = 3.0V
(b)
D.g.e., E = 3.0V
Beza keupayaan merentasi perintang, V = 2.5V
Arus yang mengalir melalui perintang,
I= V/R
I = 2.5/2 =1.25A
E = V+Ir
(3.0) = (2.5)+(1.25)r
1.25r = 3.0−2.5 = 0.5
r= 0.5/1.25
r = 0.4Ω
Mengukur d.g.e. dan Rintangan Dalam
by admin
Three methods can be used to measure the e.m.f. and internal resistance.
Rintangan Dalam dan Kehilangan Beza Keupayaan
by admin
Rintangan Dalam
Rintangan dalam bagi satu sumber elektrik (sel atau penjana) adalah rintangan terhadap cas bergerak di dalam sumber elektrik berkenaan.
Rintangan Beban
Rintangan beban dalam satu litar adalah rintangan berkesan terhadap cas bergerak di luar sumber elektrik.
Beza Keupayaan Terminal
Beza keupayaan terminal atau voltan terminal adalah beza keupayaan di kedua-dua terminal (terminal positif dan terminal negatif) sumber elektrik (sel atau penjana).
Rintangan Dalam dan Kejatuhan Beza Keupayaan
- Jika rintangan dalam boleh diabaikan, beza keupayaan terminal adalah sama dengan d.g.e
- Bagaimanapun, jika rintangan dalam hadir, maka beza keupayaan terminal adalah sentiasa lebih rendah daripada d.g.e.
- Hubungan di antara d.g.e. dan beza keupayaan terminal diberi oleh persamaan berikut.
Persamaan
E = V + Ir
or
E = IR + Ir
E = d.g.e.
V = beza keupayaan terminal
I = arus mengalir dalam litar
r = rintangan dalam
R = rintangan beban
Contoh 1:
Satu sel tertentu mempunyai rintangan dalam 0.5Ω dan beza keupayaan merentasi sel itu adalah 4V apabila arus 2A mengalir melaluinya. Cari d.g.e. sel itu.
Jawapan:
r = 0.5Ω
V = 4V
I = 2A
E = ?
E=V+Ir
E=(4)+(2)(0.5)
E=5V
Contoh 2:
Satu sel yang mempunyai d.g.e. 3V dan rintangan dalam 1Ω disambungkan ke satu perintang 5Ω. Diberi bahawa satu voltmeter disambungkan melintasi perintang seperti yang ditunjukkan dalam rajah di atas. Cari bacaan voltmeter.
Jawapan:
E = 3V
r = 1Ω
R = 5Ω
V = ?
E=I(R+r)
(3)=I(5+1)
I= 3/6 =0.5A
V=IR
V=(0.5)(5)=2.5V
Ester
by admin
- Ester ialah sebatian organik bukan hidrokarbon yang mengandungi karbon, hidrogen dan oksigen.
- Ia terbentuk apabila asid karboksilik bertindak balas dengan alkohol.
Formula Am:
CmH2m + 1COOCnH2n + 1
Di mana
m = 0, 1, 2, 3
n = 1, 2, 3
Contoh
| Ester | Formula |
| Metil metanoat (m=0, n=1) | HCOOCH3 |
| Etil metanoat (m=1, n=1) | CH3COOCH3 |
| Etil etanoat (m=1, n=2) | CH3COOC2H5 |
| Propil etanoat (m=2, n=2) | C2H5COO C2H5 |
Kumpulan berfungsi:
Pembentukan:
- Ester dihasilkan apabila asid karboksilik bertindak balas dengan alkohol dengan kehadiran asid sulfurik pekat sebagai mangkin.
- Tindak balas ini dipanggil tindak balas pengesteran.
Sifat Fizik Ester
- Ester mempunyai ciri-ciri berikut:
- Mempunyai wangi yang serupa dengan buah-buahan
- Tidak larut dalam air tetapi larut dalam pelarut organik
- Takat mendidih yang rendah
- Kurang tumpat daripada air
- Cecair tidak berwarna
- Tidak meruap
- Dalam alam semulajadi, ester boleh ditemui di dalam tumbuhan.
Kegunaan Ester dalam Kehidupan Harian
- Sebagai perisa makanan
- Sebagai pewangi dalam sabun dan detergen
- Untuk membuat barangan kosmetik (minyak wangi)
- Untuk membuat ubat
Sifat-sifat Kimia Asid Karboksilik
by admin
- Asid etanoik ialah asid monoprotik yang lemah. Oleh itu, sifat kimianya adalah serupa dengan asid yang lain seperti asid hidroklorik, asid nitrik dan asid sulfurik.
- Asid etanoik boleh bertindak balas dengan:
- bes
- logam karbonat
- logam
- alkohol
Asid Karboksilik Bertindak dengan Logam Reaktif
Asid carboxylic bertindak dengan logam yang lebih reaktif untuk menghasilkan garam dan gas hidrogen.
Asid karboksilik + Logam reaktif → Garam+ H2
Contoh:
2CH3COOH + Zn → Zn(CH3COO)2 + H2
2CH3COOH + Ca → Ca(CH3COO)2 + H2
2HCOOH + Mg → Mg(HCOO)2 + H2
Asid Karboksilik Bertindak Dengan Karbonat
Sama seperti asid lain, asid karboksilat bertindak balas dengan logam karbonat untuk menghasilkan garam, air dan karbon dioksida.
Asid Karboksilik + Karbonat logam
→ Garam+ Karbon dioksida + Air
→ Garam+ Karbon dioksida + Air
Contoh:
HCOOH + Na2CO3 → HCOONa + CO2 + H2O
CH3COOH + CaCO3 → Ca(CH3COO)2 + CO2 + H2O
Peneutralan
Sama seperti asid lain, asid karboksilik bertindak balas dengan oksida bes atau alkali untuk menghasilkan garam dan air.
Asid karboksilik + Oksida bes/Alkali → Garam + Air
Contoh:
HCOOH + CaO → Ca(HCOO)2 + H2O
CH3COOH + NaOH → CH3COONa + H2O
CH3COOH + Al2O3 → Al(CH3COO)3 + H2O
Pengesteran
Asid karboksilat bertindak balas dengan alkohol dengan kehadiran asid sulfurik pekat sebagai mangkin menghasilkan ester dan air.
Asid karboksilik + Alkohol → Ester + Air
Contoh:
CH3COOH + C2H5OH → CH3COOC2H5 + H2O
CH3COOH + CH3OH → CH3COOCH3 + H2O
- Asid sulfurik pekat bertindak sebagai
- agen pengeringan untuk menyerap air yang dihasilkan
- memangkin
- Campuran bahan tindak balas perlu dipanaskan di bawah refluks.
Penyediaan Propil Etanoate (ester) di Dalam Makmal
- Propil etanoat, CH3COOC2H5 boleh disediakan di dalam makmal dengan memanaskan campuran asid propanoik dan etanol, dengan asid sulfurik pekat di bawah refluks.
- Campuran dipanaskan di bawah refluks untuk mengelakkan alkohol dan propil etanoat daripada mengewap dan terlepas ke sekeliling.
- Campuran dipanaskan di bawah kukus air:
- untuk mengekalkan suhu supaya suhu tidak terlalu tinggi
- untuk memastikan pemanasan seragamcan

Penyediaan Asid Karboksilik
by admin
Menghasilkan Asid Karboksilik Dengan Pengoksidaan Alkohol
- Alkohol boleh dioksidakan untuk membentuk asid karboksilik dengan menggunakan larutan kalium dikromat(VI) dan kehadiran asid sulfurik cair.
- Persamaan Kimia di bawah mewakili tindak balas ini.
C2H5OH+2[O] → CH3COOH + H2O - Rajah di bawah menunjukkan radas yang digunaka untuk menyediakan asid etanoik.
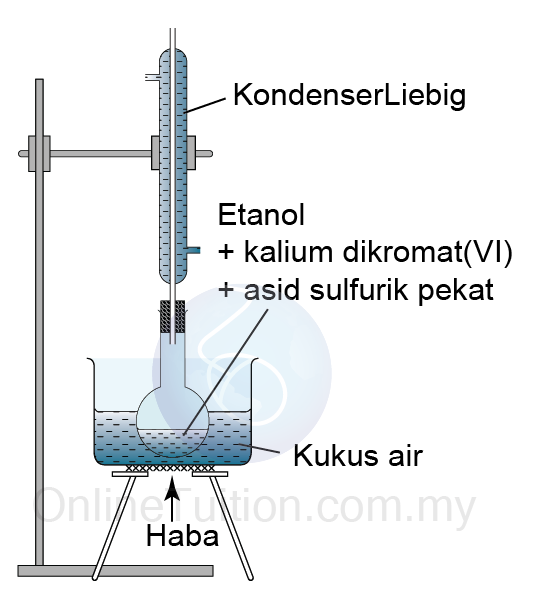
- Campuran dipanaskan di bawah refluks untuk mencegah etanol mengewap dan terlepas ke sekelilingnya sebelum ia mempunyai masa yan emncukupi untuk dioksidakan kepada asid karboksilik.
- Wap etanol akan dikondensasi menjadi cecair dalam kondenser Liebig, seterusnya mengalir kembali ke dalam balang untuk menyelesaikan tindak balas.
- Campuran ini dipanaskan dengan menggunakan kukus air:
- untuk memastikan suhu adalah tetap
- untuk memastikan pemanasan seragam (haba dibekalkan dengan sama rata)