Kemolaran Asid dan Kemolaran Ion Hidrogen
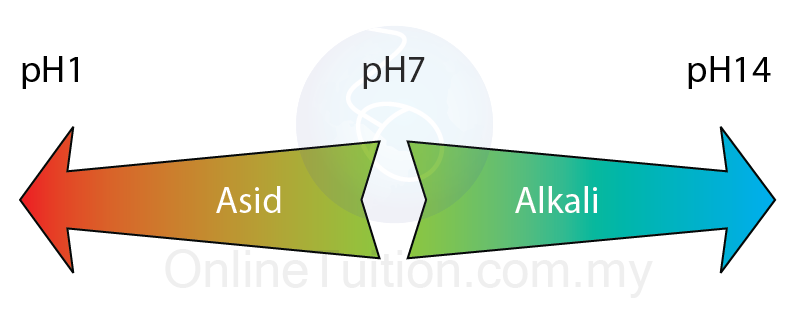
- Nilai pH satu larutan bergantung kepada kepekatan ion hidrogen larutan itu.
- Semakin tinggi kepekatan ion hidrogen, semakin rendah nilai pH.
- Kepekatan atau kemolaran ion hidrogen suatu asid bergantung kepada
- kemolaran asid
- kekuatan asid
- kebesan asid
Kemolaran Asid dan nilai pH
| Kemolaran Asid Hidroklorik | Kemolaran Ion H+ | pH |
| 0.1 mol/dm3 | 0.1 mol/dm3 | 1 |
| 0.05 mol/dm3 | 0.05 mol/dm3 | 1.3 |
| 0.01 mol/dm3 | 0.01 mol/dm3 | 2 |
- Kepekatan ion hidrogen di dalam suatu asid bergantung kepada kepekatan asid itu. Semakin tinggi kepekatan asid semakin tinggi kepekatan ion hidrogen di dalam asid.
- Dalam jadual di atas, semakin rendah kepekatan asid hidroklorik, semakin rendah kepekatan ion hidrogen, Maka semakin tinggi nilai pH asid itu.
Kekuatan Asid dan Nilai pH
| Asid | Kepekatan Asid | Kepekatan Ion Hidrogen | pH |
| Asid Hidroklorik (Asid kuat) | 0.1 | 0.1 | 1 |
| Asid Etanoik (Asid lemah) | 0.1 | 0.001 | 3 |
- Asid lemah mengion separa di dalam air. Oleh itu kemolaran ion hidrogennya lebih rendah daripada kemolaran asid.
- Contohnya, di dalam jadual di atas, kemolaran asid etanoik ialah 0.1 mol/dm3 manakala kemolaran ion hidrogen hanya 0.001 mol/dm3. Ini adalah kerana kebanyakan molekul etanoik tidak mengurai di dalam air membentuk ion hidrogen.
- Oleh itu, nilai pH asid lemah adalah lebih tinggi daripada nilai pH asid kuat jika kemolaran kedua-dua asid adalah sama.
Kebesan Asid dan Nilai pH
| Asid | Kepekatan Asid | Kepekatan Ion Hidrogen | pH |
| Asid Hidroklorik (Asid monobes) | 0.1 | 0.1 | 1 |
| Asid Sulfurik (Asid dwibes) | 0.1 | 0.2 | 0.7 |
- Kebesan asid ialah bilangan ion hidrogen yang dapat dihasilkan oleh 1 molekul asid.
- Bagi asid dwibes, setiap molekul asid menghasilkan dua ion hidrogen.
H2SO4 → 2H+ + SO42-
Oleh itu, kepekatan ion hidrogen asid dwibes adalah dua kali ganda kepekatan asid. - Oleh itu, nilai pH asid dwibes adalah lebih rendah daripada Nilai pH asid monobes jika kepekatannya adalah sama dan kedua-duanya ialah asid kuat.

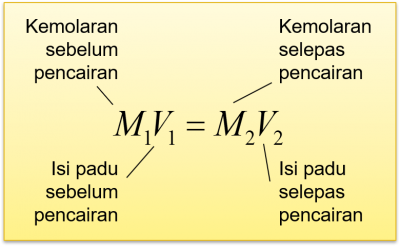
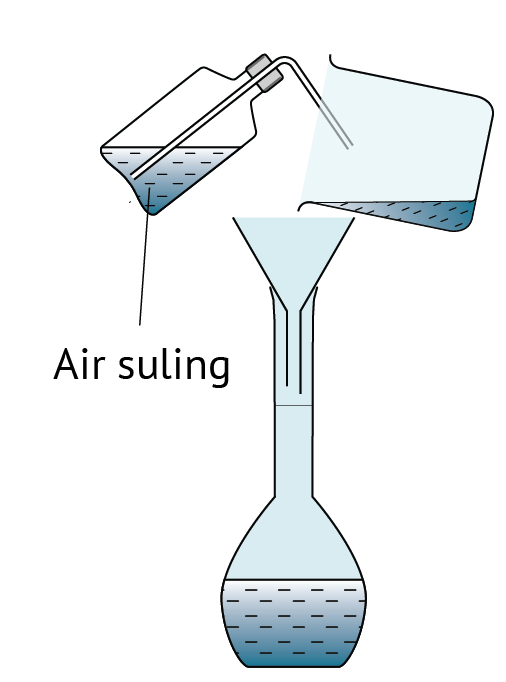
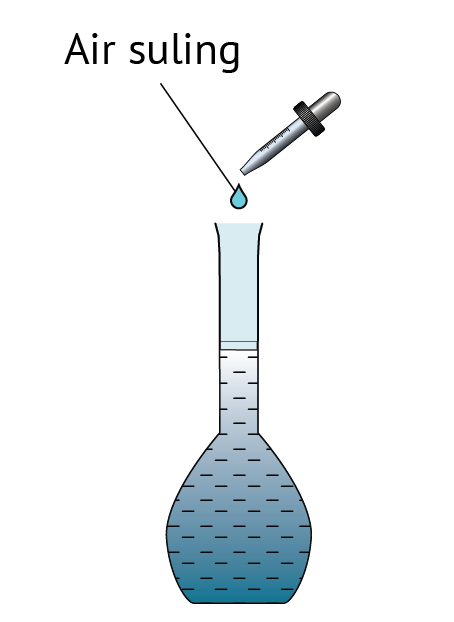
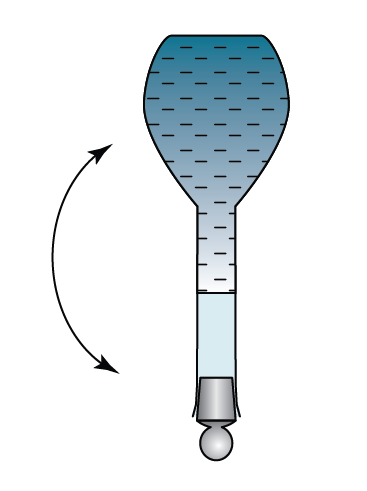


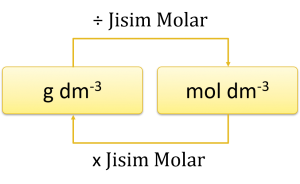
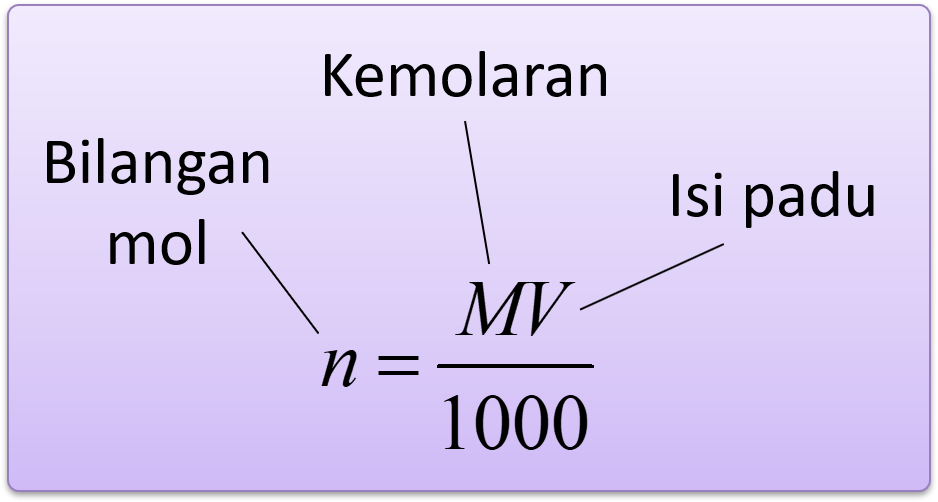 Dalam rumus di atas, unit isi padu ialah cm3.
Dalam rumus di atas, unit isi padu ialah cm3.