[adinserter block=”3″]
- Kadar tindak balas ditakrifkan sebagai perubahan jumlah bahan tindak balas atau hasil tindak balas per unit masa.

- Ia adalah satu ukuran betapa cepat suatu tindak balas berlaku.
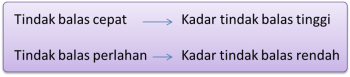
- Bagi suatu tindak balas yang berlaku dengan cepat dalam satu tempoh masa yang singkat, kadar tindak balasnya adalah tinggi.
- Bagi suatu tindak balas yang berlaku dengan lambat dalam satu tempoh masa yang panjang, kadar tindak balasnya adalah rendah.
Contoh-contoh tindak balas cepat
| Jenis tindak balas | Contoh |
| Pembakaran | Pembakaran magnesium dalam oksigen \[2Mg + {O_2} \to 2MgO\] Pembakaran etana (C2H6) \[{C_2}{H_6} + \frac{7}{2}{O_2} \to 2C{O_2} + 3{H_2}O\] |
| Tindak balas antara logam dengan air | Tindak balas di antara kalium dan air \[2K + 2{H_2}O \to 2KOH + {H_2}\] |
| TIndak balas antara karbonat logam dengan asid | Tindak balas di antara batu kapur/marmar dan asid sulfurik \[\begin{gathered} CaC{O_3} + {H_2}S{O_4} \hfill \\ \to CaS{O_4} + C{O_2} + {H_2}O \hfill \\ \end{gathered} \] |
| Tindak balas pemendakan (Penguraian ganda dua) | Pemendakan argentum(I) klorida \[AgN{O_3} + HCl \to AgCl + HN{O_3}\] |
Contoh-contoh tindak balas perlahan
| Jenis tindak balas | Contoh |
| Foto sintesis | \[6C{O_2} + 6{H_2}O \to {C_6}{H_{12}}{O_6} + 6{O_2}\] |
| Pengaratan | \[4Fe + 3{O_2} + 2{H_2}O \to 2F{e_2}{O_3} \bullet 2{H_2}O\] |
| Penapaian | \[{C_6}{H_{12}}{O_6} \to 2{C_2}{H_5}OH + 2C{O_2}\] |
[adinserter block=”3″]