Kesan Suhu Ke Atas Kadar Tindak Balas
Semakin tinggi suhu larutan, semakin tinggi kadar tindak balas.
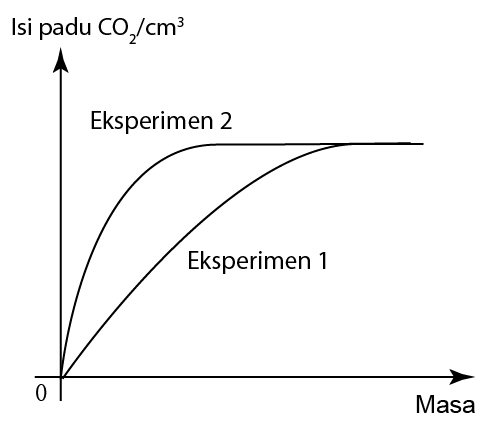
Eksperimen
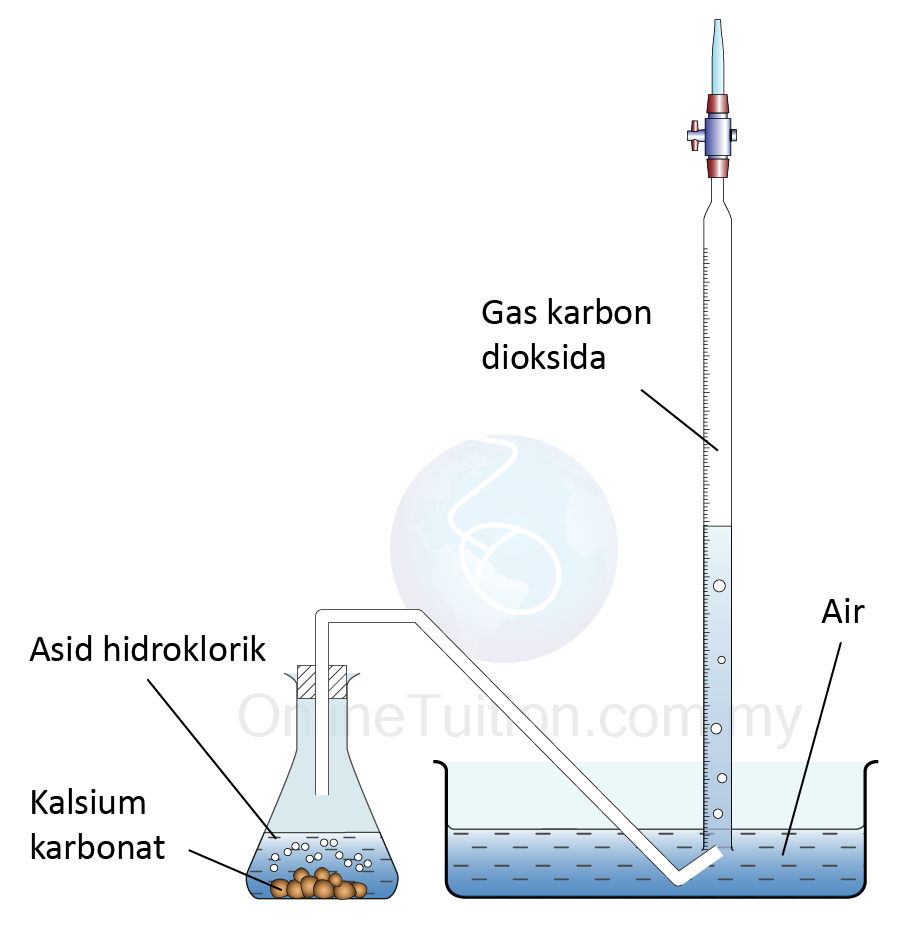
Dengan mengukur masa yang diambil untuk pembentukan mendakan sulfur (pepejal kuning) apabila asid sulfurik, H2SO4 bertindak balas dengan natrium thiosulfat (VI), Na2S2O3 pada suhu yang berbeza, kita boleh menyiasat kesan suhu bahan tindak balas ke atas kadar tindak balas.
Persamaan Kimia
H2SO4 + Na2S2O3 → Na2SO4 + S + SO2 + H2O
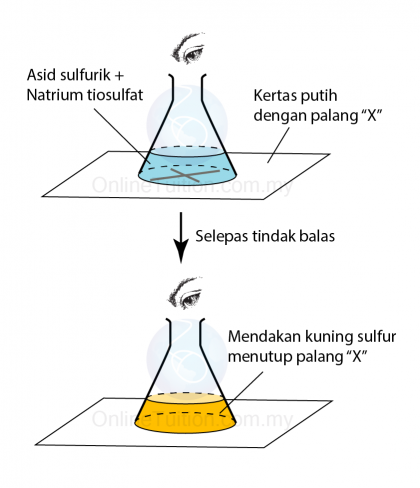
Prosedur:
- 50 cm3 larutan natrium thiosulfat 0.2 mol dm-3 pada 30ºC di tambah kepada 10 cm3 daripada asid sulfurik 0.5 mol dm-3
- Masa yang diambil untuk tanda ̔X diletakkan di bawah kelalang kon hilang dari pandangan direkodkan.
- Eksperimen diulang dengan menggunakan larutan natrium thiosulfat dengan suhu 35ºC, 40ºC, 45ºC dan 50ºC.
Kesimpulan 1:
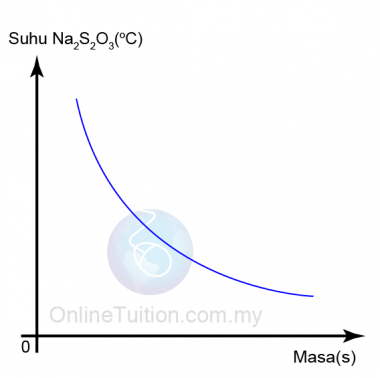

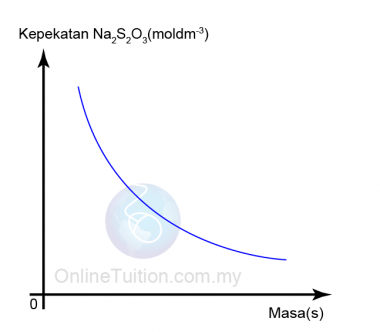
- Graf suhu natrium thiosulfat (VI), Na2S2O3 melawan masa yang diambil untuk mendakan sulfur terbentuk diplotkan.
- Daripada graf, kita dapati apabila suhu larutan natrium thiosulfat bertambah, masa diperlukan untuk ditandakan ̔X ‘ hilang berkurang.

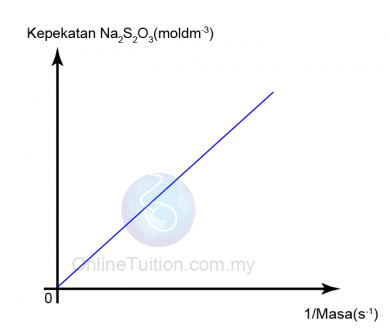
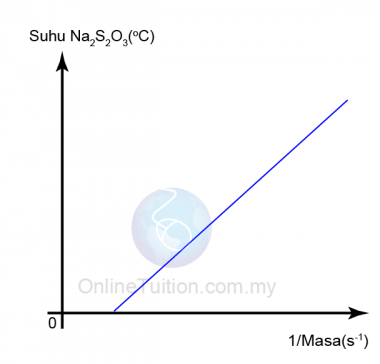
- Graf suhu natrium thiosulfat (VI), Na2S203 melawan 1/masa diambil diplotkan.
- Apabila suhu natrium thiosulfat meningkat, nilai 1/masa bertambah.
- Kita perlu ambil perhatian bahawa 1/masa = kadar tindak balas.
- Semakin tinggi suhu larutan natrium thiosulfat, semakin tinggi kadar tindak balas.