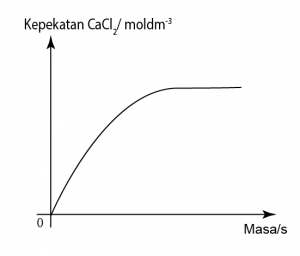
Contoh
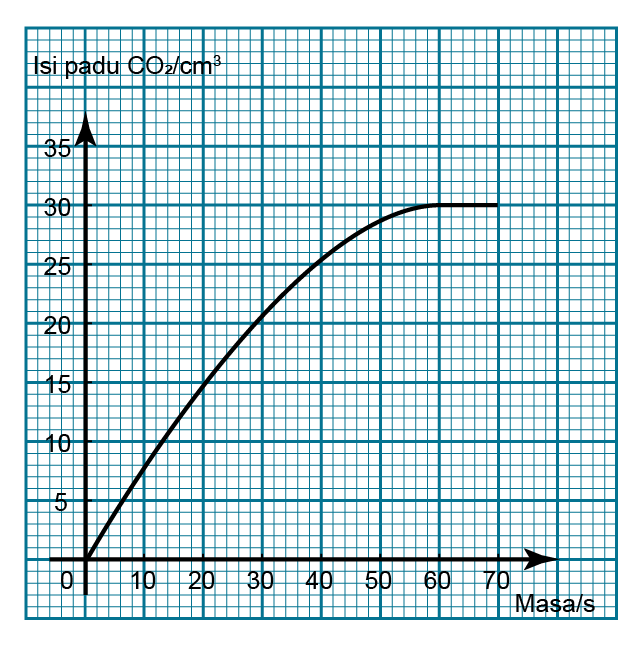
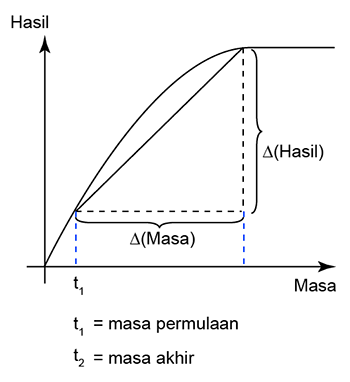
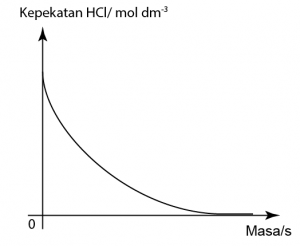
Dalam tindak balas antara kalsium karbonat dan larutan asid hidroklorik, gas karbon dioksida yang dilepaskan dikumpulkan dalam buret. Graf di atas menunjukkan jumlah isi padu gas karbon dioksida yang dikumpul dari masa ke masa. Cari kadar purata tindak balas pada 60-saat yang pertama.
Jawapan: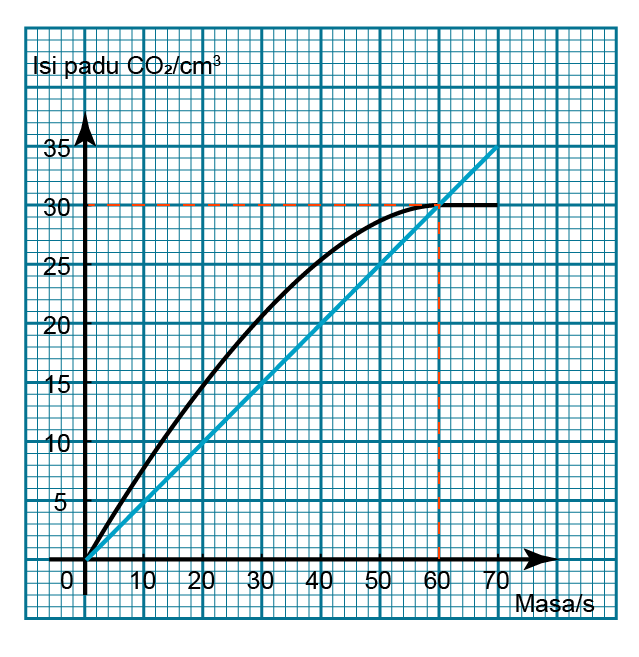 Lukis satu garis lurus melalui masa t = 0s dan t = 60s.
Lukis satu garis lurus melalui masa t = 0s dan t = 60s.
Perubahan masa = 60s
Penembahan isis padu CO2 = 30cm3




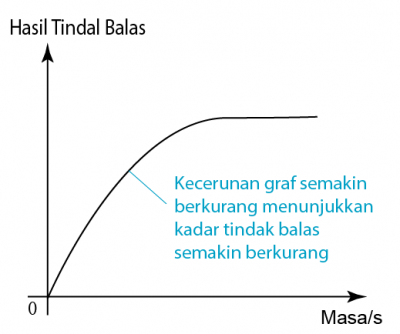
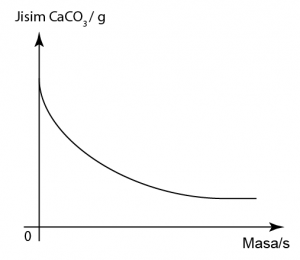 Marmar yang digunakan adalah berlebihan. Oleh itu kuantitinya tiday jatuh ke 0 di akhir tindak balas.
Marmar yang digunakan adalah berlebihan. Oleh itu kuantitinya tiday jatuh ke 0 di akhir tindak balas.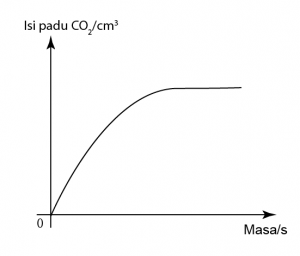
 d.
d.