admin
admin
Lemak Tepu dan Lemak Tak Tepu
- Molekul lemak tepu ialah molekul di mana asid lemaknya hanya mengandungi ikatan kovalen karbon tunggal (- C – C -).
- Molekul lemak tak tepu ialah molekul yang mengandungi asid lemak yang mempunyai ikatan kovalen tunggal (- C – C -) dan ikatan ganda dua (- C = C -) di antara atom-atom karbon dalam rantaian hidrokarbonnya.
- Lemak tak tepu boleh ditukar kepada lemak tepu apabila bertindak balas dengan gas hidrogen pada suhu 180° dengan kehadiran nikel sebagai pemangkin.
- Tindak balas ini ialah tindak balas penambahan.
- Proses ini digunakan dalam pembuatan marjerin.
Jadual di bawah meringkaskan perbezaan antara lemak tepu dan lemak tak tepu.
| Lemak tepu | Lemak tak tepu |
| Terdiri daripada asid lemak tepu. Asid lemak tepu tidak mempunyai ikatan berganda antara atom karbon dalam rantai asid lemak. | Terdiri daripada asid lemak tak tepu, yang mengandungi satu atau lebih ikatan berganda dalam rantai asid lemak. |
| Titik lebur yang lebih tinggi. | Takat lebur yang lebih rendah. |
| Wujud sebagai pepejal pada suhu bilik. | Wujud sebagai cecair pada suhu bilik. |
| Tidak boleh dihidrogenkan. | Boleh dihidrogenkan. |
| Kandungan kolesterol tinggi | Tiada kolesterol |
Lemak
- Minyak dan lemak tergolong dalam sekumpulan sebatian organik yang dikenali sebagai lipid.
- Minyak dan lemak ialah ester semulajadi.
- Lemak terdapat pada haiwan.
- Minyak yang terdapat dalam kedua-dua haiwan dan tumbuh-tumbuhan.
Struktur Molekul
Perbezaan antara Minyak dan Lemak
- Lemak adalah pepejal pada suhu bilik manakala minyak adalah cecair pada suhu bilik.
- Takat lebur lemak lebih tinggi daripada takat lebur minyak.
Sabun
- Asid lemak ialah asid karboksilik yang mengandungi 4-28 karbon dalam molekul.
- Sabun adalah garam natrium atau kalium bagi asid lemak.
- Formula am sabun ialah RCOO–Na+ atau RCOO–K+, di mana R adalah kumpulan alkil yang mempunyai rantai karbon yang panjang.
- Rajah di bawah menunjukkan struktur am molekul sabun.

- Rajah di bawah menunjukkan contoh molekul sabun (Natrium Stearat)
Haba Pembakaran
Pembakaran
- Pembakaran ialah tindak balas di mana satu bahan membakar sepenuhnya di dalam oksigen berlebihan.
- Contohnya, pembakaran metana dalam oksigen berlebihan menghasilkan karbon dioksida dan air.
CH4 + 2O2 → CO2 + 2H2O - Semua pembakaran bahan api adalah tindak balas eksotermik.
Haba Pembakaran
Haba Pembakaran satu bahan ialah tenaga haba yang dibebaskan apabila 1 mol bahan dibakar sepenuhnya dalam oksigen berlebihan dalam keadaan piawai.
Menentukan Haba Pembakaran
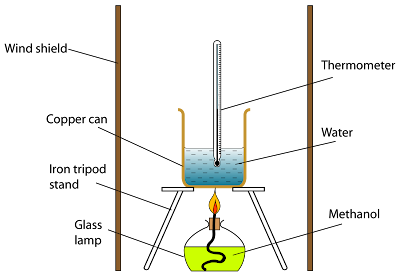
Rajah di bawah menunjukkan kaedah mudah untuk mendapatkan nilai anggaran bagi haba pembakaran satu bahan api.
- Satu lampu dengan bahan api dinyalakan dan tenaga haba yang dikeluarkan digunakan untuk memanaskan satu isi padu air yang tetap.
- Jisim bahan bakar ditimbang dan kenaikan suhu maksimum dicatat.
- Haba pembakaran dapat dikira dengan menggunakan formula
Kita membuat anggapan bahawa semua tenaga haba yang dibebaskan dari pembakaran bahan bakar diserap oleh air.
Langkah Berjaga-Jaga
- Gunakan pelindung angin untuk menyekat aliran udara. Ini dapat mengurangkan kehilangan haba ke sekitarnya.
- Jangan mengguna kasa dawai dalam pemanasan untuk mengurangkan kehilangan haba.
- Bekas kuprum digunakan kerana kuprum ialah konduktor haba yang baik,
- Api mesti diletakkan berhampiran dengan bekas,
- Air selalu dikacau dengan termometer.
- Peningkatan suhu air dihadkan di bawah 30 ° C untuk mengelakkan pemanasan berlebihan dan kehilangan tenaga ke sekitarnya,
- Bahan bakar ditimbang dengan kerap untuk mengelakkan kondensasi.
Haba Peneutralan
Revision Notes
- Haba peneutralan ialah tenaga haba dibebaskan apabila asid bertindak balas dengan bes dan menghasilkan satu mol air. Semua pengukuran dibuat dalam keadaan piawai.
- Contoh haba tindak balas peneutralan ialah perubahan haba yang diperoleh dalam tindak balas antara natrium hidroksida dan asid hidroklorik. Persamaan bagi tindak balas ini ialah
∆H = -57 kJ mol-1
Contoh-Contoh Tindak Balas Peneutralan
Persamaan | Persamaan Setengah |
| HCl + NaOH → NaCl + H2O | H+(aq) + OH–(aq) → H2O(l) |
| H2SO4 + 2KOH → K2SO4 + 2H2O | H+(aq) + OH–(aq) → H2O(l) |
| CH3COOH + NaOH → CH3COONa +H2O | H+(aq) + OH–(aq) → H2O(l) |
| 2HNO3 + Ba(OH)2 → Ba(NO3)2 + 2H2O | H+(aq) + OH–(aq) → H2O(l) |
- Haba peneutralan asid kuat dengan alkali kuat hampir sama bagi semua asid dan alkali. Ini kerana tindak balas yang sama selalu berlaku. Tindak balasnya ialah H+(ak) + OH–(ak) → H2O(c)
- Perubahan haba tindak balas peneutralan dipengaruhi oleh 3 faktor:
- Kuantiti asid dan alkali
- Kebesan asid dan alkali
- Kekuatan asid dan alkali
Contoh:
Satu eksperimen dijalankan dengan menambahkan 25cm3 natrium hidroksida 0.5 mol/dm³ ke dalam 25 cm³ asid nitrat cair 0.5 mol/dm³. Hitung perubahan suhu campuran itu. [Muatan haba tentu larutan = = 4.2 Jg-1 ° C-1, ketumpatan larutan = 1 g / cm³]
Jawapan:
Bilangan mol NaOH,
\[\begin{gathered}
n = \frac{{MV}}{{1000}} \hfill \\
n = \frac{{(0.5)(25)}}{{1000}} \hfill \\
n = 0.125mol \hfill \\
\end{gathered} \]
Bilangan mol HNO3,
\[\begin{gathered}
n = \frac{{MV}}{{1000}} \hfill \\
n = \frac{{(0.5)(25)}}{{1000}} \hfill \\
n = 0.125mol \hfill \\
\end{gathered} \]
Bilangan mol air dihasilkan = 0.0125mol
Kuantiti haba dibebaskan,
Q = 0.0125 x 57,000J = 712.5J
Jsim larutan,
m = 25 + 25 = 50 cm³
Muatan haba tentu larutan = 4.2 Jg-1°C-1
Q = mcθ
712.5 = 50(4.2)θ
θ = 3.4°
Haba Penyesaran
Haba penyesaran ialah perubahan tenaga apabila satu mol logam disesarkan daripada larutan garamnya oleh logam yang lebih elektropositif
- Tindak balas penyesaran berlaku apabila logam yang berada pada kedudukan yang lebih tinggi dalam siri elektrokimia menggantikan logam di bawahnya dari larutan garamnya.
- Haba penyesaran ialah perubahan tenaga apabila satu mol logam disesarkan daripada larutan garamnya oleh logam yang lebih elektropositif
- Tindak balas penyesaran merupakan tindak balas eksotermik.
- Contoh di bawah menunjukkan bagaimana haba penyesran dapat dikira.
2HCl(ak) + Zn(p) → ZnCl2 (ak) + H2(g)
Bilangan mol asid hidroklorik \begin{gathered} n = \frac{{MV}}{{1000}} \hfill \\ n = \frac{{(2.0)(50)}}{{1000}} \hfill \\ n = 0.1mol \hfill \\ \end{gathered} Bilangan mol gas hidrogen yang dihasilkan = 0.1/2=0.05mol Jumlah haba dibebaskan Q = mcθ Q = (50)(4.2)(57-27) Q = 6300J \[\begin{gathered} \Delta H = \frac{{{\text{Perubahan haba}}}}{{{\text{Bilangan mol mendakan terbentuk}}}} \hfill \\ = \frac{{6300}}{{0.05}} \hfill \\ = 126,000Jmo{l^{ – 1}} = 126kJmo{l^{ – 1}} \hfill \\ \end{gathered} \]Haba Pemendakan
- Haba pemendakan ialah perubahan tenaga apabila satu mol mendakan terbentuk daripada ionnya.
- Tindak balas pemendakan berlaku apabila dua larutan yang mengandungi kation dan anion bagi satu garam tidak larut dicampur bersama.
- Tindak balas ini dikenali sebagai tindak balas penguraian berganda dan digunakan untuk menyediakan garam yang tidak larut.
- Haba pemendakan adalah perubahan tenaga apabila satu mol mendakan terbentuk daripada ionnya.
- Bagi haba pemendakan, ia mungkin satu tindak balas eksotermik atau endotermik.
- Contoh di bawah menunjukkan bagaimana haba pemendakan dapat dikira dari hasil eksperimen.
Contoh:
Dalam satu eksperimen untuk mencari haba pemendapan magnesium karbonat, 25 cm³ magnesium nitrat 2.0 mol/dm³ ditambahkan ke dalam 25 cm³ larutan natrium karbonat, 2.0 mol dm³ dalam satu bekas. Suhu larutan menurun sebanyak 6 ° C. Berapakah haba pemendakan magnesium karbonat? [Muatan haba tentu larutan = 4.2 Jg-1 ° C-1 ; Ketumpatan larutan = 1 g/cm³]
Jawapan:
\[\begin{gathered}
n = \frac{{MV}}{{1000}} \hfill \\
n = \frac{{(2.0)(25)}}{{1000}} \hfill \\
n = 0.05mol \hfill \\
\end{gathered} \]
\[\begin{gathered}
n = \frac{{MV}}{{1000}} \hfill \\
n = \frac{{(2.0)(25)}}{{1000}} \hfill \\
n = 0.05mol \hfill \\
\end{gathered} \]
Bilangan mol magnesium karbonat terbentuk = 0,05 mol
= 1260J
Haba pemendakan magnesium karbonat
\[\begin{gathered}
\Delta H = \frac{{{\text{Perubahan haba}}}}{{{\text{Bilangan mol mendakan terbentuk}}}} \hfill \\
= \frac{{1260}}{{0.05}} \hfill \\
= 25200Jmo{l^{ – 1}} = 25.2kJmo{l^{ – 1}} \hfill \\
\end{gathered} \]
Menhitung Haba Tindak Balas
Haba tindak balas bagiu suatu tindak balas boleh dihitungkan dengan menggunakan formula berikut:
\[\begin{gathered}
{\text{Haba tindak balas, }}\Delta {\text{H}} \hfill \\
{\text{ = }}\frac{{{\text{Perubahan tenaga}}}}{{{\text{Bilangan mol bahan/hasil tindak balas}}}} \hfill \\
\end{gathered} \]
Perubahan haba dapat dikira dengan menggunakan persamaan
Q = mcθ
m = jisim bahan yang menyerap haba
c = muatan haba tentu bagi bahan yang menyerap haba
θ = perubahan suhu
Nota penting:
- Kita selalu menggunakan muatan haba tentu air sebagai penghampiran kepada muatan haba tentu semua jenis larutan berair.
- Kita juga menggunakan ketumpatan air sebagai penghampiran kepada ketumpatan semua larutan berair.
- Oleh kerana ketumpatan air adalah 1g / cm³, oleh itu setiap cm³ larutan / air sama dengan 1 g. Contohnya 50cm³ ≡ 50g dan 200cm³ ≡ 200g.
Contoh 1:
Apabila 50 cm³ asid sulfurik ditambahkan ke dalam 40 cm³ larutan kalium hidroksida, suhu larutan meningkat daripada 29.0 ° C ke 42.0 ° C. Hitung perubahan tenaga haba dalam tindak balas ini. (Muatan haba tentu larutan = 4.2 Jg-1 ° C-1)
Jawapan:
m = 50 cm³ + 40 cm³ = 90 cm³
c = 4.2 Jg-1°C-1
θ = 42 – 29 = 13°C
Perubahan tenaga haba
= mcθ
= (90)(4.2)(13) = 4914J
Contoh 2:
Apabila 20 cm³ larutan kalium karbonat ditambah ke dalam 20 cm³ larutan kalsium nitrat dan campuran dikacau dengan segera. Suhu larutan berubah daripada 29.5 ° C ke 28.0 ° C. Hitung perubahan tenaga haba dalam tindak balas ini. (Muatan haba tentu larutan = 4.2 Jg-1 ° C-1)
Jawapan:
m = 20 cm³ + 20 cm³ = 40 cm³
c = 4.2 Jg-1°C-1
θ = 29.5 – 28 = 1.5°C
Perubahan haba
= mcθ
= (40)(4.2)(1.5) = 252J
Contoh 3:
Apabila 100 cm³ asid hidroklorik, 2 mol/dm³ ditambahkan ke dalam 100 cm³ natrium hidroksida, 2 mol/dm³, suhu campuran meningkat daripada 28.5 ° C kepada 42.0 ° C. Cari haba peneutralan tindak balas.
[Muatan haba tentu larutan = = 4.2 Jg-1 ° C-1, ketumpatan larutan = 1 g/cm³]
Jawapan:
Persamaan kimia tindak balas,
Bilangan mol asid hidroklorik,
\[\begin{gathered}
n = \frac{{MV}}{{1000}} \hfill \\
n = \frac{{(2.0)(100)}}{{1000}} \hfill \\
n = 0.2mol \hfill \\
\end{gathered} \]
Bilangan mol natrium hidroksida,
\[\begin{gathered}
n = \frac{{MV}}{{1000}} \hfill \\
n = \frac{{(2.0)(100)}}{{1000}} \hfill \\
n = 0.2mol \hfill \\
\end{gathered} \]
Bilangan mol air dihasilkan = 0.2 mol
Perubahan tenaga haba,
= mcθ
= (100+100)(4.2)(42.0-28.5) = 11340J
Haba peneutralan,
\[\begin{gathered}
\Delta {\text{H = }}\frac{{{\text{Perubahan haba}}}}{{{\text{Bilangan mol air dihasilkan}}}} \hfill \\
\Delta {\text{H = }}\frac{{11340}}{{0.2}} \hfill \\
\Delta {\text{H = 56700Jmo}}{{\text{l}}^{ – 1}} \hfill \\
\end{gathered} \]
Menghitung Perubahan Haba
Perubahan haba dalam tindak balas kimia berkadar langsung dengan bilangan mol bahan tindak balas yang mengambil bahagian dalam tindak balas atau bilangan mol hasil tindak balas yang dihasilkan.
Contoh 1:
N (g) + ½ O2 (g) → NO2 (g) ∆H = +66 kj mol-1
Hitung perubahan haba apabila 0.1 mol nitrogen dioksida terbentuk dalam tindak balas yang ditunjukkan di atas.
Jawapan:
Perubahan haba = 0.1 x 66kJ = 6.6 kJ
Contoh 2:
Berapa banyak tenaga yang dibebaskan apabila 4g karbon membakar sepenuhnya dalam oksigen berlebihan. (Jisim atom relatif karbon = 12)
Jawapan:
Bilangan mol karbon
Jumlah haba yang dibebaskan
Contoh 3:
CH3OH(l) + O2 (g)
→ CO2 (g) + 2H2O (l) ∆H = 560 kJ mol-1
Cari jisim alkohol yang perlu dibakar dalam oksigen berlebihan untuk membebaskan 140 kJ tenaga haba.
[Jisim atom relatif: H = 1; C = 12; 0 = 16]
Jawapan:
Bilangan mol alkohol
Jisim molekul relatif CH3OH
= 12 + 3 (1) + 16 + 1 = 32
Jisim alkohol = 0.25 mol x 32g/mol = 8g
Contoh 4:
Hitungkan perubahan haba apabila serbuk zink yang berlebihan ditambahkan ke dalam 50cm³ larutan kuprum (II) sulfat 0.2 mol dm-3
Jawapan:
Bilangan mol larutan sulfat kuprum (II) sulfat
Perubahan haba = 0.01 x 190kJ = 1.9kJ
Contoh 5:
Diberi haba pembakaran karbon kepada CO2 ialah -393.5kJ/mol. Hitungkan haba yang dibebaskan semasa pembentukan 35.2g CO2 daripada pembakaran karbon dalam oksigen berlebihan.
Jawapan:
Jisim molekul relatif karbon dioksida
= 12 + 2 (16) = 44
Bilangan mol karbon dioksida
= 35.2 / 44 = 0.8 mol
Daripada persamaan tindak balas
C + O2 → CO2
1 mol karbon menghasilkan 1 mol gas karbon dioksida, oleh itu bilangan mol karbon = 0.8 mol
Haba dibebaskan = 0.8 x 393.5kJ = 314.8 kJ